



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
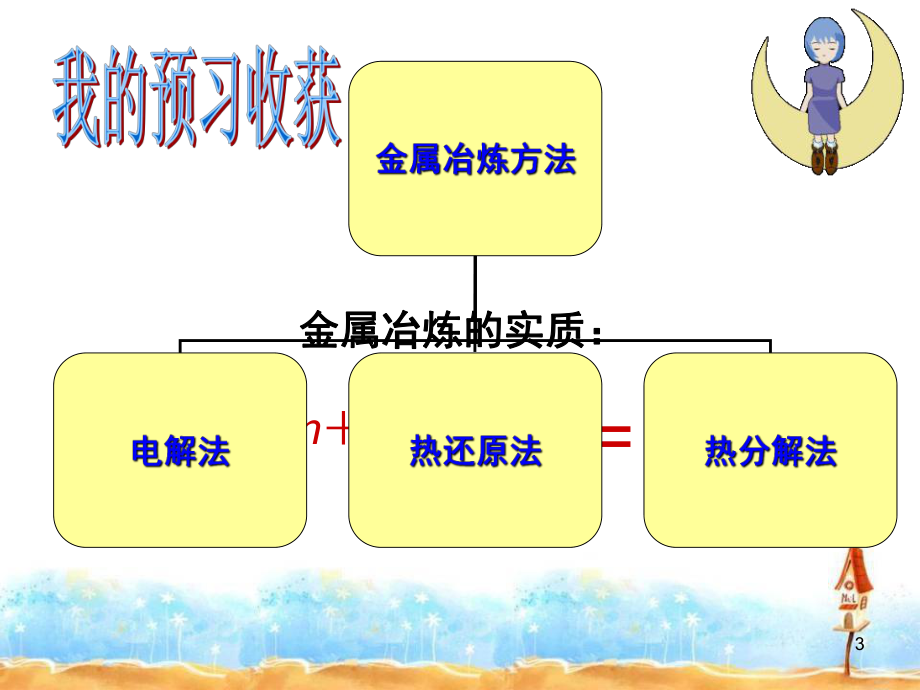
1、1濮阳市第二高级中学濮阳市第二高级中学 朱朱 利利 平平人教版必修二第四章第一节第一课时人教版必修二第四章第一节第一课时 金属矿物的开发利用金属矿物的开发利用金属铝的冶炼及应用金属铝的冶炼及应用21.1.了解金属冶炼的原理了解金属冶炼的原理, ,熟记几种常见金属的熟记几种常见金属的 冶炼方法。冶炼方法。2.2.通过探究铝的冶炼,初步体验工艺流程题通过探究铝的冶炼,初步体验工艺流程题 的解决方法的解决方法, ,进一步巩固元素化合物的知识。进一步巩固元素化合物的知识。3.3.掌握铝热反应的原理,能正确书写相应的化掌握铝热反应的原理,能正确书写相应的化 学反应方程式。学反应方程式。3 金属冶炼的实质
2、:金属冶炼的实质: Mnne = M4以上方法分别适用于哪些金属?以上方法分别适用于哪些金属?K Ca Na Mg g Al Zn Fe Sn Pb (H) Cu Hg g Ag g Pt Au电解法电解法热还原法热还原法热分热分解法解法5冶炼金属常用以下几种方法:冶炼金属常用以下几种方法:以以C、CO或或 H2 作还原剂还原。作还原剂还原。电解法。电解法。热分解法。热分解法。下列金属各采用哪种方法还原下列金属各采用哪种方法还原最佳最佳。Fe、Zn、Cu等中等活泼的金属等中等活泼的金属( )Na、Mg、Al等活泼或较活泼金属等活泼或较活泼金属( )Hg、Ag等不活泼金属等不活泼金属( )678
3、 如何从铝土矿(主要含如何从铝土矿(主要含AlAl2 2O O3 3、 SiOSiO2 2、FeFe2 2O O3 3)中制备金属铝呢?中制备金属铝呢?写出相应的化学反应方程式。写出相应的化学反应方程式。 提供试剂:提供试剂: 稀盐酸、氢氧化钠溶液、氨水、二氧化碳气体稀盐酸、氢氧化钠溶液、氨水、二氧化碳气体 9流程图示例10FeCl3+3NaOH=Fe(OH)3 +3NaClNaAlO2+CO2+2H2O=Al(OH)3+NaHCO34 411 Al(OH)Al(OH)3 3铝土矿铝土矿 过滤过滤 过滤过滤NaHCONaHCO3 3足量的稀盐酸足量的稀盐酸SiOSiO2 2足量的氢氧足量的氢氧
4、 化钠溶液化钠溶液足量的二氧足量的二氧 化碳气体化碳气体Fe(OH)Fe(OH)3 3 过滤过滤Al2O3Al电解电解FeClFeCl3 3 AlClAlCl3 3 NaAlONaAlO2 2 NaClNaCl加加热热 NaClNaCl121314 Al(OH)Al(OH)3 3铝土矿铝土矿 过滤过滤 过滤过滤NHNH4 4ClCl足量的稀盐酸足量的稀盐酸FeFe2O O3足量的氢氧足量的氢氧 化钠溶液化钠溶液足量的氨水足量的氨水H H2 2SiOSiO3 3 过滤过滤Al2O3Al电解电解NaNa2 2SiOSiO3 3 NaAlONaAlO2 2 AlClAlCl3 3 NaClNaCl4
5、Al = 冰晶石+3O2 2Al2O3(熔融)电解加加热热 NaClNaCl15Al O 熔点 2050C1000C 霍霍 尔尔助熔剂助熔剂161718191.引发反应时,镁条及氯酸钾分别起了什么作用?引发反应时,镁条及氯酸钾分别起了什么作用? 2.你看到了哪些现象?这些现象分别说明了什么?你看到了哪些现象?这些现象分别说明了什么?3.请写出该反应的化学方程式请写出该反应的化学方程式,指出铝热剂的成分。指出铝热剂的成分。铝热反应铝热反应镁燃烧放出热量为反应提供高温条件,氯酸钾受镁燃烧放出热量为反应提供高温条件,氯酸钾受热分解生成氧气作助燃剂。热分解生成氧气作助燃剂。剧烈燃烧,有红热的物质落入沙
6、中,该物质冷却后能剧烈燃烧,有红热的物质落入沙中,该物质冷却后能被磁铁吸引。说明反应放出大量的热被磁铁吸引。说明反应放出大量的热, ,产物有单质铁。产物有单质铁。2Al + Fe2Al + Fe2 2O O3 3 = Al = Al2 2O O3 3 + 2Fe + 2Fe 高温高温铝热剂铝热剂铝与某些熔点较高活泼性比铝弱的铝与某些熔点较高活泼性比铝弱的金属氧化物之间的氧化还原反应金属氧化物之间的氧化还原反应203MnO3MnO2 2+4Al +4Al = = 3Mn+2Al3Mn+2Al2 2O O3 3 高温高温高温高温3V3V2 2O O5 5+10Al =+10Al = 6V+5Al6V+5Al2 2O O3 3请写出铝分别与二氧化
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2024年度业务联络函两篇8篇
- 新时代教师十项准则自查报告6篇
- 有关幼儿园小班学期班级工作计划四篇
- 项目报销广联达梦龙科技公司房建客户部张帅飞-返回-浙江台州医院
- 教研组长述职报告
- 农村厕改调查报告
- 通信行业报告
- 江苏省连云港市灌云县西片2022-2023学年七年级下学期5月月考数学试卷(含解析)
- 欢度国庆节的作文如何写最好5篇
- 2023初中生综合表现评语80句
- 深圳市失业人员停止领取失业保险待遇申请表样表
- 盐度对养殖鱼类的影响有哪些
- 美国加州婴儿安全出生证明翻译模板
- 快乐学习 课件(共23张ppt) 心理健康
- 如何培养成长型思维-高中心理健康
- 二类障碍、异常(未遂)管理标准-
- SMT印刷检验标准
- 道路绿化工程表格范例
- 连锁酒店市场营销试题
- 砂石路面施工组织设计
- 昆明新工人文化宫商业策划运营报告

评论
0/150
提交评论