



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
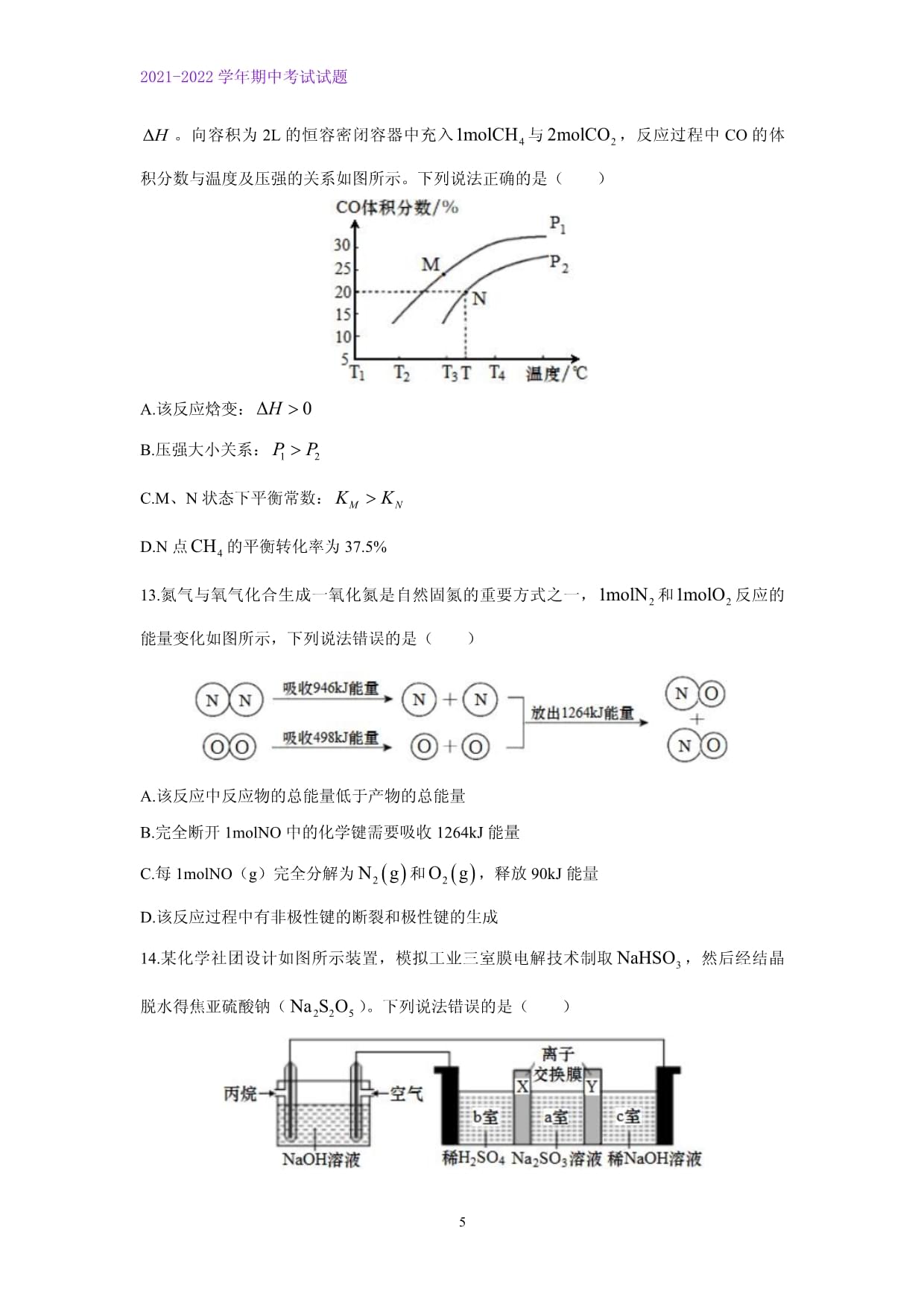
2021-2022学年期中考试试题PAGEPAGE1山东省青岛市4区市2021-2022学年高二上学期期中考试说明:1.本试卷分为选择题和非选择题两部分,考试时间90分钟,满分100分。2.选择题〖答案〗用2B铅笔涂在答题卡上,非选择题用0.5mm黑色中性笔作答,〖答案〗必须写在答题卡各题目指定区域内的相应位置。可能用到的相对原子质量:H1C12N14O16Na23S32Cu64一、选择题:本题共10小题,每小题2分,共20分,每小题只有一个选项符合题意。1.化学与能源息息相关。下列说法错误的是()A.煤的干馏、气化和液化都属于化学变化B.风能、电能、地热能等都属于一次能源C.光合作用是将太阳能转变为化学能的过程D.锌锰干电池和氢氧燃料电池都属于一次电池2.下列说法错误的是()A.冰在室温下自动熔化成水,这是熵增加的过程B.用湿润pH试纸测定溶液的pH值,可能引起数据偏差C.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属D.铅蓄电池工作时,理论上每消耗1mol硫酸转移个电子3.下列关于反应速率与反应限度的说法正确的是()A.钠与水反应时,增加水的用量能明显增大反应速率B.合成氨工业采用循环操作的主要目的是提高平衡体系中氨的含量C.催化剂能加快反应速率的原因是它能降低反应的活化能,减小反应的焓变D.升温能提高反应物的能量,增大反应物间的碰撞频率,加快反应速率4.利用下列实验装置无法实现实验目的的是()①②③④A.用装置①测量2%双氧水分解生成的化学反应速率B.用装置②制备并能较长时间观察其颜色C.用装置③证明生石灰与水反应是放热反应D.用装置④探究温度对化学平衡的影响5.在密闭容器中发生储氢反应:。在一定温度下,达到平衡状态,测得氢气压强为2MPa。下列说法正确的是()A.高温条件有利于该反应正向自发,利于储氢B.降低温度,v正增大,v逆减小,平衡正向移动C.缩小容器的容积,重新达到平衡时的浓度增大D.该温度下压缩体积至原来的一半,重新达到平衡时压强仍为2MPa6.应用电解法对煤进行脱硫处理具有脱硫效率高、经济效益好等优点。电解脱硫的基本原理如图所示,下列说法错误的是()A.中Fe元素表现+2价B.阳极电极反应式为C.电解过程中,阴极至少有两种离子放电D.混合液中每产生,有被还原7.一定温度下,在一容积可变的密闭容器中发生反应,时刻达到平衡,时刻改变某一条件,至时刻再次达到平衡,v逆随时间变化如图所示。下列说法错误的是()A.过程中,平衡逆向移动B.时刻改变的条件可能是充入一定量HI(g)C.Ⅰ、Ⅱ两过程达平衡时,平衡常数D.Ⅰ、Ⅱ两过程达平衡时,H2的体积分数Ⅰ<Ⅱ8.下列有关电解质及其电离的说法正确的是()A.升温促进水的电离,从而使水的pH值减小B.氨水的导电性一定比NaOH溶液的导电性弱C.某醋酸溶液的pH=4,说明醋酸是弱电解质D.在水中能电离产生,故其溶液显酸性9.一定温度下,在两个容积相等的密闭容器中加入一定量的反应物发生反应:,有关数据如下。下列说法错误的是()容器编号起始时各物质的物质的量/mol达到平衡的时间/min达到平衡时体系能量的变化CO①1400放出热量:32.8kJ②2800放出热量:QA.容器①中CO的转化率为80%B.容器②中反应的平衡常数K=1C.若不考虑热量损失,则Q>65.6kJD.平衡反应速率:容器②>容器①10.深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(一种厌氧微生物,适宜pH为7~8)的作用下,能被硫酸根离子腐蚀,原理如图。下列有关说法正确的是()A.腐蚀过程中,土壤酸性逐渐增强B.输送暖气铁管道温度越高,越易发生此类腐蚀C.正极反应为D.管道壁镶嵌锌块或锡块都可保护管道不易被腐蚀二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。11.NO催化生成的过程由以下三步基元反应构成:第1步:;第2步:;第3步:。下列说法正确的是()A.三步基元反应都是放热反应B.第1步是总反应的决速步C.该过程共有三种中间产物D.总反应的焓变为12.与反应得到合成气的原理为。向容积为2L的恒容密闭容器中充入与,反应过程中CO的体积分数与温度及压强的关系如图所示。下列说法正确的是()A.该反应焓变:B.压强大小关系:C.M、N状态下平衡常数:D.N点的平衡转化率为37.5%13.氮气与氧气化合生成一氧化氮是自然固氮的重要方式之一,和反应的能量变化如图所示,下列说法错误的是()A.该反应中反应物的总能量低于产物的总能量B.完全断开1molNO中的化学键需要吸收1264kJ能量C.每1molNO(g)完全分解为和,释放90kJ能量D.该反应过程中有非极性键的断裂和极性键的生成14.某化学社团设计如图所示装置,模拟工业三室膜电解技术制取,然后经结晶脱水得焦亚硫酸钠()。下列说法错误的是()A.丙烷为负极,发生氧化反应B.a室产生,故X、Y依次为质子交换膜、阳离子交换膜C.随着电解反应的进行,b、c室中的电解质溶液浓度均逐渐减小D.制得反应的化学方程式为15.一定温度下,向容积不等的恒温恒容密闭容器中分别加入足量活性炭和气体,发生反应。反应相同时间,测得各容器中的转化率与容器容积的关系如图所示。下列说法正确的是()A.b、c两点均为平衡状态B.a点所示条件下一定满足C.向b点体系中充入一定量,平衡右移,体积分数增大D.对c点容器加压,缩小容器体积,此时Q、K关系一定为Q>K三、根据题意填空、简答:共5道题,60分,〖答案〗填写在答题卡上。16.(12分)根据如图所示实验装置,回答相关问题。装置1 装置2 装置3(1)“装置1”中铁钉发生的电化学腐蚀类型为____________,石墨电极的电极反应式为________________________。(2)“装置2”中外电路电子的移动方向为______(填“由a到b”或“由b到a”),该装置发生的总反应的离子方程式为________________________。(3)“装置3”中甲烧杯盛有100mLNaCl溶液,乙烧杯盛有100mLCuSO4溶液。一段时间后,铜电极增重1.28g。①直流电源的M端为______极,乙烧杯中电解反应的化学方程式为__________________。②装置3产生的气体在标准状况下的体积为______mL;欲恢复乙烧杯中的溶液至电解前的状态,可加入______(填字母标号)。a. b.1.6gCuOc. d.17.(12分)研究的再利用有利于低碳减排的同时获得新的能源物质。如一定条件下,加氢可制得甲醇:。回答下列问题:(1)我国科研人员研究的该反应历程如图,吸附在催化剂表面上的物种用“*”表示,“TS”表示过渡态,括号里的数字表示微粒的相对总能量(单位为eV)。该反应______0(填“>”或“<”);该历程中总反应的决速步方程式为________________。(2)T℃时,在一容积为2L的恒容密闭容器中充入2mol和6molH2,测得不同时刻容器中的压强关系如下表所示:时间/min510152025300.800.720.660.620.600.60①用表示该反应0~5min内的平均反应速率为______。②的平衡转化率为______;T℃时,该反应的平衡常数为______(保留一位小数)。③其它条件不变,下列措施能同时增大反应速率和平衡转化率的是______(填标号)。a.升高温度 b.按原比例再充入一定量和c.将和液化移出 d.缩小容器体积18.(12分)某化学小组利用酸性与草酸()反应,设计以下实验探究化学反应快慢的影响因素。实验用品:溶液、溶液、稀硫酸、蒸馏水、溶液、5mL量筒、胶头滴管、井穴板、细玻璃棒及秒表等实验内容及记录:实验编号试管中所加试剂及用量/mL温度/℃紫色褪去所需时间/min溶液溶液稀硫酸蒸馏水①2.01.01.02.0204.1②3.01.01.0203.7③1.01.02.080t回答下列问题:(1)写出酸性与草酸反应的离子方程式__________________。(2)=______mL,=______mL,理由是________________________。(3)欲探究温度对反应速率的影响,应选择的实验是______(填编号)。(4)为验证“对该反应有催化作用”,该小组同学用如图装置进行了实验④和⑤,其中实验所用酸性溶液由稀硫酸与溶液以体积比1∶1混合所得。实验④:向一个井穴中滴入10滴溶液,逐滴加入酸性溶液,并记录各滴加入后的褪色时间。实验⑤:向三个井穴中分别滴加10滴溶液,依次滴加1、2、3滴溶液和3、2、1滴蒸馏水,搅拌均匀,再各滴加1滴酸性溶液,并记录褪色时间及混合体系颜色变化。实验记录如下:实验④溶液第1滴第2滴第3滴第4滴第5滴紫色褪去所需时间/s10020105出现褐色沉淀实验⑤溶液1滴2滴3滴体系颜色变化:红色→浅红色→无色蒸馏水3滴2滴1滴紫色褪去所需时间/s121616已知:为难溶于水的褐色固体;溶液呈红色,不稳定,会缓慢分解为和。i.实验④中第5滴出现褐色沉淀可能的原因是__________________(用离子方程式表示)。ii.实验④和⑤的现象验证了“对该反应有催化作用”,催化过程如下:实验⑤中催化剂用量增加,褪色时间却略有延长,说明催化剂过量易催化到“催化过程”的第______步,反应过程出现红色的原因是________________________。19.(12分)已知pOH也可以用来表示溶液的酸碱度,规定。不同温度下,水溶液中pOH与pH的关系如图所示。回答下列问题:(1)t______25(填“>”或“<”),图中A、B、C三点对应水的电离程度由大到小的顺序是______。(2)25℃时,向溶液中逐滴加入等浓度的溶液至恰好沉淀完全。①此过程中水的电离平衡______(填“正向”、“逆向”或“不”)移动。②写出该过程发生反应的离子方程式__________________;若反应前后溶液体积的变化忽略不计,则反应后所得溶液的pH值为______(已知)。(3)已知80℃时,水的离子积常数。该温度下,某一元酸(HA)溶液中,该溶液中由水电离的为______,用电离方程式表示该溶液中存在的电离平衡__________________。20.(12分)、是大气主要污染物,有效去除烟气中的、是环境保护的重要课题。回答下列问题:(1)汽车尾气系统中安装催化转化器可大大减少等汽车尾气的排放。已知:i.ii.iii.标准压力下,在进行反应的温度时,由最稳定的单质合成1mol物质的反应焓变,叫做该物质的标准摩尔生成焓。25℃时几种物质的标准摩尔生成焓如下:物质(g)CO(g)(g)NO(g)标准摩尔生成焓()3390①反应i的______。②已知对于反应ⅱ:,(、为速率常数)。若在2L恒容密闭容器中充入2molCO和2molNO发生上述反应,在一定温度下反应达到平衡时,CO的转化率为25%,则______(计算结果用分数表示)。(2)一定条件下,烟气中的与能发生反应:。某小组向密闭容器中充入等体积的和发生上述反应,测得平衡时压强对数和的关系如图所示。①______(填“高于”或“低于”);温度为时,该反应的化学平衡常数为______(为以平衡分压代替平衡浓度计算的平衡常数)。②同一温度下,图像呈线性变化的理由是__________________;a、b两点体系总压强与的比值______。(3)目前,科学家还在研究一种以乙烯作为还原剂的脱硝(NO)原理,机理如左下图,若反应中乙烯与NO的体积比为1∶3,则该脱硝原理总反应的化学方程式为__________________;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如右下图,为达到最佳脱硝效果,应选择的条件是________________________。
▁▃▅▇█参*考*答*案█▇▅▃▁1.B2.C3.D4.B5.D6.D7.D8.A9.C10.C11.BD12.AD13.B14.AC15.BC非选择题:16.(12分)(1)吸氧腐蚀(1分),O2+4e﹣+2H2O=4OH﹣(2分)(2)由b到a(1分),2Fe3++2I﹣=2Fe2++I2(2分)(3)①正(1分),2CuSO4+2H2O2Cu+O2↑+2H2SO4(2分)②672(2分);bc(1分)17.(12分)(1)<(2分);HCOOH*(g)+2H2(g)=H2COOH*(g)+eq\f(3,2)H2(g)(2分)(2)①0.24mol·L﹣1·min﹣1(2分)②80%(2分);14.8(2分)③bd(2分)18.(12分)(1)2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O(2分)(2)1.0(1分),2.0(1分),控制单一变量,保持溶液总体积为6.0mL,确保其他反应物浓度不变(1分)(3)①③(2分)(4)i.2MnO4﹣+3Mn2++2H2O=5MnO2↓+4H+(2分)ii.Ⅱ(1分),溶液褪色时间延长是因为过量的Mn2+能使MnO4﹣迅速变成Mn3+,Mn3+与C2O42﹣结合生成MnC2O4+而出现红色
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2024安全员理论考试带答案(培优)
- 2024年【安全员(初级)】考试题库含答案(培优)
- 2024年保密知识竞赛题库附答案(达标题)
- 2024年安全员从业资格证及保安岗位职责题库及1套参考答案
- 2024年安全员从业资格证及保安岗位职责题库附参考答案(b卷)
- 2024年安全员考试题库带答案(预热题)
- 2024年安全员证考试题库含答案(突破训练)
- 2024年版安全员(初级)内部模拟考试题库(夺冠)
- 2024年版高校教师资格证内部模拟考试题库(模拟题)
- 2024年高级安全员模拟试题(含答案)
- 建筑工程施工班组中途退场协议书
- 客服电话接听技巧与标准
- 管理干部问责管理办法
- 酒店管理专业建设情况调查问卷(学校)
- XXXX学校教师落实“双减”“五管理”任务目标责任书
- 医院感染监测清单
- 2020年中国桃种植面积、产量及贸易情况分析图
- 湖北地区医院详细名单一览表
- 主变安装作业指导书详解
- 6-1-2沟壑纵横的黄土高原
- 2019最新司法鉴定程序通则

评论
0/150
提交评论