



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、论著人乳头瘤病毒18型L1蛋白在大肠埃希菌中的可溶性表达及病毒样颗粒的形成安静,付生芳,李雄雄,包红,寇桂英,白幕群,余黎兰州生物制品研究所有限责任公司甘肃省疫苗工程研究中心,甘肃兰州730046摘要:目的利用大肠埃希菌系统可溶性表达人乳头痛病毒18型(HPV18)L1蛋白,纯化和审组装获得HPV18病毒样颗粒(VLPs),为进一步研制HPV18基因工程疫苗奠定基础。方法首先按大肠埃希菌密码子偏好进行HPV18IJ全基因合成,经PCR扩增出截短的HPV18L1基因,构建重组表达载体PET30a-Ll,通过优化表达在大肠埃希菌BL21中可溶性表达L1蛋白,其次采用硫酸铉沉淀、离子交换层析、疏水层
2、析后,获得高纯度的的L1蛋白,再通过解聚和重聚获得VLPs。结果全基因优化并截短的UPV18L1蛋白在大肠埃希菌系统中以可溶形式表达,纯化后的蛋白纯度达到90%以上,电镜下观察到直径为60nm的VLPs颗粒。结论利用大肠埃希菌系统可溶性表达非融合HPV18L1蛋白,并获得均一的VLPs颗粒,为疫苗的开发奠定基础。关键词:大肠埃希菌表达系统;人乳头痛病毒18型;L1蛋白;优化;可溶性表达;病毒样颗粒中图分类号:R373.9文献标志码:ADOI:10.13309/ki.pmi.2014.05.003SolubleexpressionofHPVtype18LIproteinfromEscherich
3、iacoliandformationofvirus-likeparticlesANJing,FUSheng-fang,LIXiong-xiong,BAOHong,KOUGui-ying,BAIMu-qun,YULilanzhouInstituteofBiologicalProductsCo.,Lld.,CenterforGansuProvincialVaccineEngineeringResearch,Ixinzhou730046.GansuProvince,ChinaCorrespondingauthorANJing,E-mail:xil2000Abstract:ObjectiveToexp
4、ressthemajorstructuralproleinLIofHumanpapillomavirustype18(HPVI8)asasolublefonninE.coliBI21.LIproteinwaspurifiedandre-assembledintovirus-likeparticles(VLPs)invitr(».Thislaidafoundationoffurtherdevelopmentofgeneticallyengineeredvaccines.MethodsFull-lengthgeneofHPVtype18Liwassynthesizedacconiingt
5、othecodonbiasofE.coli.ThetruncatedLIgenewasamplifiedbyPCR.TheamplifiedLIfragmentwasinsertedintoanexpressionvectorPET30aandwasexpressedinaformofsolubleproteininE.colibyanexpressionoptimization.ThenLIproteinwaspurifiedbyammoniumsulfateprecipitation,ion-exchangechromatographyandhydrophobicinteractionch
6、romatography.LIwassubjectedtoself-assemblyVLPswithdisassemblyandreassembly.ResultsHPVtype18LIproteinwithafull-lengthgeneoptimizationandtnincatedmodewasexpressedinasolubleforminE.colisystem.ThepurityofpurifiedLIproleinismorethan90%.ObservationbytransmissionelectronicmicroscopyshowedthattheVLPsformedi
7、naroundshapewithadiameterabout60nm.ConclusionNufusionHPVLIproteinwasexpressedasasolu-bleformfromE.coliandsubjectedtoformuniformVLPs,whichmayprovideanusefultoolfordevelopmentofHPVvaccines.Keywords:Escherichiacoli(E.coli)expressionsystem;Humanpapillomavirustype18(HPV18);LIprotein;Optimization;Solublee
8、xpression;Virus-likeparticles(VLPs)人乳头瘤病毒(Humanpapillomavirus,HPV)是一种小DNA病毒,无包膜,迄今发现HPV有100多种型别,分为高危型和低危型。分子流行病学调查作者简介:安静,副研究员.主要从事病毒性疫苗的研发。通讯作者:安静,E-maill:xiL2OOO表明,某些型别的持续感染与宫颈癌的发生密切相关,在所有宫颈癌标本中HPVDNA的检出率高达80%。HPV18在世界大部分地区宫颈癌患者中是仅次于HPV16的第二位常见高危型HPV,但HPV18较HPV16具有更强的恶性转化能力2。因此,一种安全有效的HPV18型疫苗可以极大
9、地降低妇女宫颈癌的发病率,具有良好的社会效益和经济效益。由于HPV很难在体外培养,加之又有潜在的致癌性,因而传统的灭活疫苗和减毒活疫苗技术不适合研制HPV18型疫苗,于是基因工程表达蛋白成为研究的主要手段。L1蛋白结构保守,含多个抗原表位,在真核和原核系统中表达后可自我组装成病毒样颗粒(VLP),其结构和抗原表位与天然病毒颗粒十分相似,能剌激机体产生保护性抗体,是HPV18预防性疫苗的主耍靶抗原为此,研究利用安全、廉价的大肠埃希菌系统可溶性表达HPV18L1蛋白,通过纯化获得高纯度的目标蛋白,去除二硫苏糖醇后在体外自我折叠形成VLPs,为HPV18预防性疫苗的研制奠定基础。1材料和方法1.1质
10、粒、菌种由GenScript提供全基因优化的HPV18L1甘油菌PUC57-HPV18L1/TOP10;PET30a载体、BL21(DE3)宿主曲.由兰州生物制品研究所有限贵任公司(简称兰州公司)第二研究室保存并提供。1.2主要试剂Nde【、Xhol购自TaKaRa;蛋白豚、酵母抽提物购自日本株式会社;NaCl购自北京化工厂;PCR纯化试剂盒购自QIAGEN;抗HPV18L1单克隆抗体购自SANTACRUZ;二硫苏糖醇(DTT)、辣根过氧化物前标记兔抗鼠IgC均购自Sigma313全基因合成按大肠埃希曲.的密码子偏好进行全基因合成,在不改变赛基酸序列的前提下,按照大肠埃希萌的密码子偏好进行HP
11、V18L1全基因合成,从密码子的适应指数、GC含量、mRNA二级结构儿方面进行优化。1.4 HPV18L1蛋白亲水性预测于WWW.E预测PCR扩增截短的HPV18L1基因,根据Genscript合成的HPV18L1基因,用Primeir5.0分别设t卜引物,正向引物:LIS:5'-ATACATATGCGTC-CGAGCGACAATACCG-3',下划线是Ndel的酶切位点,反向引物:L1A:TAACTCGAGTTAlTATfT-GCGGGCACGGAC,下划线是Xhol的酶切位点。以合成的HPV18L1基因为模版进行PCR扩增,反应条件:94V.5min;9
12、4X.45s,54°C.45s,72弋45s,30个循环;72T延伸5min01%琼脂糖凝胶电泳鉴定PCR产物并回收目的片段。将该片段插入PGEM-TEasy载体中,获得重组载体PGEMTeasy-LI,转化大肠埃希菌感受态细胞。1.5 非融合表达栽体PET30a-L1的构建提取PGEMTeasy-LI和PET30a质粒,均采用Ndel和Xhol双酶切,分别回收目的片段和线性载体,连接、转化参照分子克隆。构建的非融合表达载体PET30a-Ll进行双酶切鉴定。1.6 可溶目的蛋白的优化表达及重组蛋白的免疫印迹检测将构建好的阳性重蛆菌活化后接种LB培养基,37Y培养4h,然后加入质量体积
13、终浓度为0.5mmol/L的IPTG,分别在27Y、30Y、37T继续培养4h,离心收集菌体。加入细胞裂解缓冲液,超生破碎后,离心收集上清,用25%硫酸铉沉淀后,收集样品进行SDS-PAGE检测。样品经SDS-PAGE电泳,转移硝酸纤维素薄膜,脱脂奶粉封闭,加入抗HPV18L1单克隆抗体和辣根过氧化物酶标记兔抗鼠IgC,进行免疫印迹Western-blot检测。1.7表达蛋白的纯化阳性重组菌在27Y诱导表达后,离心收集菌体,加入细胞裂解缓冲液,超声波破碎,收集上清,加入质量体积终浓度为25%(v/v)的饱和硫酸铉溶液,待充分沉淀后,离心收集沉淀,再加入复溶缓冲液(10n)M的磷酸盐缓冲液,30
14、0mM的NacI),充分搅拌后,离心收取上清。先采用HitrapTMSPHP进行纯化,收集洗脱峰,然后用Hi-trapTMButylHP再进行纯化,收集洗脱峰进行SDS-PAGE检测。1.8HPV18病毒样颗粒的组装和形态学检查将经过两步纯化后的目标蛋白中补加DTr至终浓度100mmol/L,置室温反应2h,随后将目的蛋白置于10倍体积的PBS中透析,充分去除DT1、,使目标蛋白自我折叠形成VLPs。取样品10心,滴至铜网,经磷鸨酸染色,用H-7100FA透射电镜观察。2结果2.1全基因合成按大肠埃希菌密码子偏好进行全基因合成,HPV18L1全基因序列合成后,与原始序列相比,氨基酸序列未发生改
15、变,密码子的适应指数(Codonadaptationindex,CAI)从0.66上调至0.87,增加编码序列中的GC含缺延长mRNA半衰期,去除了mRNA的二级结构。这说明适合度有所改善,可以尝试在大肠埃希菌中进行表达。2.2亲水性预测HPV18L1蛋白亲水性预测结果表明,L1蛋白的最初165个aa是一个跨膜区域,有很强的疏水性,见图1中用绿色表示出来的起始部分氨基酸,将该段区域截除,截短后的I蛋白的亲水性预测结果见图2,起始部分转变成黄色表示的亲水性氨基酸。图1全长LI蛋白的亲水性预测Fig.1Predictionofhydrophilicityforthefull-lengthLIpro
16、tein图2截短的L】蛋白亲水性预测Fig.2PredictionofhydrophilicityforthetruncatedLIprotein2.3PCR扩增截短的HPV18LI基因PCR扩增产物经琼脂椎凝胶电泳检测,可见约1500bp的片段,与预期大小相符,见图3。将该片段插入PGEM-TEasy载体,经Ndel和Xhol双酶切鉴定,电泳出现3015pb和1512bp的条带,分别为载体和目的片段,说明重组克隆载体构建成功,见图4。15«4bp7I375bp1512bp3S3()bpI5K4bpJ3015bp1512bp1375bp<注:1:DNAmarker;2:HPV1
17、8LI基因。图.3HPV18L1基因PCR扩增产物电泳图Fig.3ElectrophresisprofileforPCRproductofPV18LIgene注:1:DNAmarker;2:HPV18LI基因。图.3HPV18L1基因PCR扩增产物电泳图Fig.3ElectrophresisprofileforPCRproductofPV18LIgene注:1:XDNAmarker;2:用Ndel和Xhol双iW切PGEMTEasy-Ll裁体。图.4重组克隆载体PGEMTEasy-Ll的瓣切鉴定Fig.4RestrictionmapofrecombinantcloningvectorPGEMT
18、Easy-Ll2.4非融合表达栽体的签定重组原核表达载体PET30a-LI的双酶切产物经琼脂糖凝胶电泳检测,可见约5600bp的载体片段和I500bp左右的目的基因片段(图5),与预期结果一致,表明垂组表达载体构建成功。S5<MM)45(MM>54MMN»注:I:XDNAmarker;2:PET30a-Ll用Ndel和Xhol双册切签定。图5直组质粒PET30a-LI的双酶切樱定Fig.5RestrictioninapofrecombinantplasmidPET30a-Ll2.5可溶目的蛋白的优化表达及重组蛋白的免疫印迹目标蛋白在27rjor.37r3种温度进行诱导表达
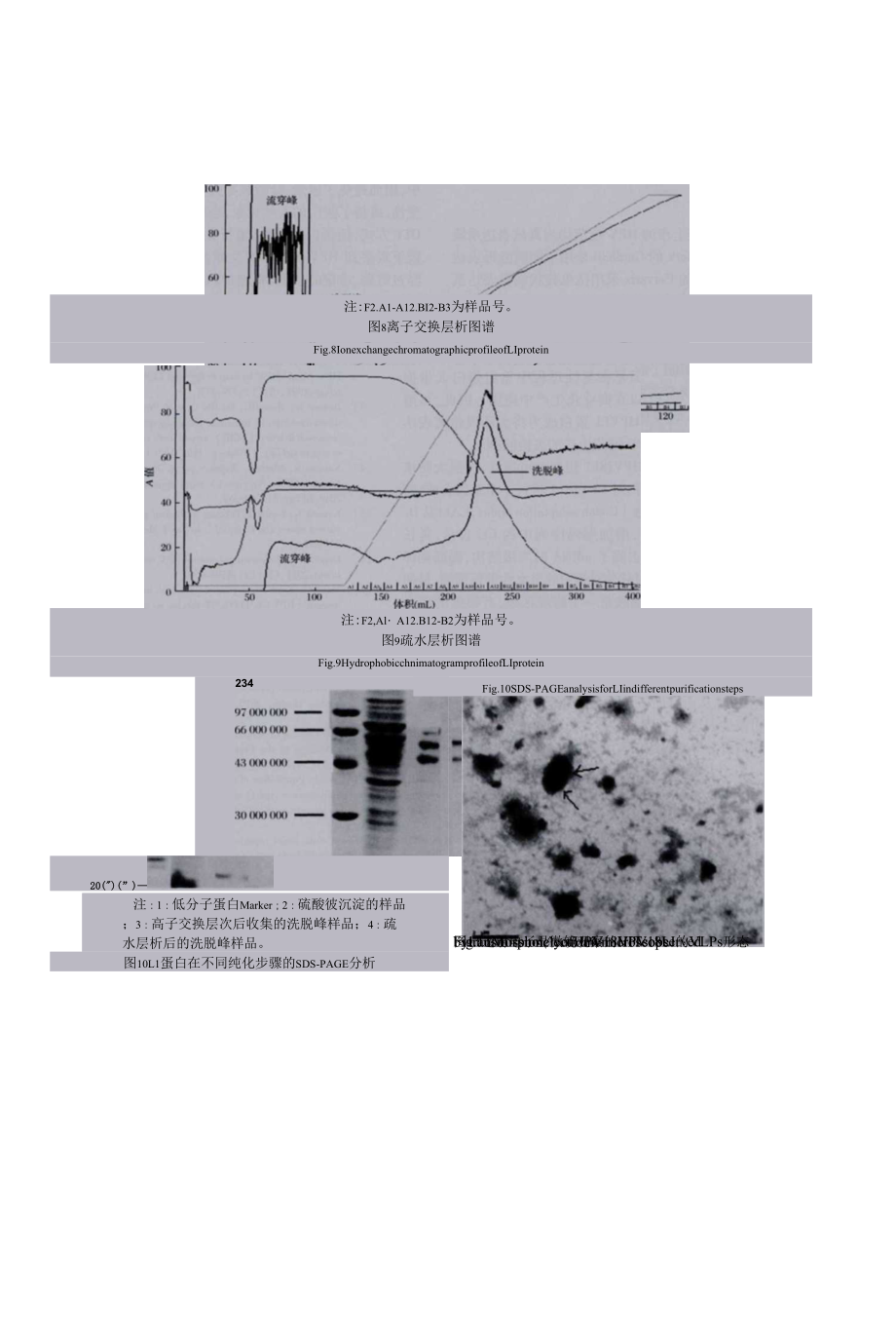
19、,样品处理后对上清进行SDS-PAGE鉴定,在相对分子质枇55(XX)处可见表达条带,27T时诃溶蛋白的表达量最高,见图6。免疫印迹Westernblot分析显示,重组可溶蛋白可与抗HPV18-LI单克隆抗体反应,在相对分子质量55000处可见特异性反应条带,45000处有一条很弱的降解条带,说明更组蛋白有较好的免疫反应性,见图7。20(XX)注:1:27达的1蚩白;2:30笆表达的LI蛋向;3:37*表达的LI蛋白;4:分子械标准。图6不同温度下L1蛋白的诱导表达F1&.6TheexpressionofLIproteinatdifferenttemperatures26表达蚤白的纯化
20、离子交换层析图谱见图.8,如图所示出现一个大的流穿峰和一个洗脱峰,收集洗脱峰样品,可进行疏水层析,结果见图9,图中显示有一个大的流穿峰和一个洗脱峰,收集洗脱峰,多步纯化后的I蛋白经SDS-PAGE分析,在相对分子质量55000处可见目标蛋白条带,45000处是降注:1:4溶的LI蚩白;2:生物腐标记的蚩白Marler图7LI可溶蛋白的免疫印迹分析Fig.7WesternblotanalysisofsolubleLIprotein解条带,纯度达到90%以上,见图10。2.7病毒样颗牲的组装和形态学检查重:折叠后的HPVI8L1的在透射电镜下观察可见大小均一、半径约30nm的球状空心颗粒,大小与H
21、PV18天然病毒颗粒相近,电镜结果见图II,箭头指示为VLPO注:F2.A1-A12.BI2-B3为样品号。图8离子交换层析图谱Fig.8IonexchangechromatographicprofileofLIprotein注:F2,AlA12.B12-B2为样品号。图9疏水层析图谱Fig.9HydrophobicchnimatogramprofileofLIprotein23420(")(”)注:1:低分子蛋白Marker;2:硫酸彼沉淀的样品;3:高子交换层次后收集的洗脱峰样品;4:疏水层析后的洗脱峰样品。图10L1蛋白在不同纯化步骤的SDS-PAGE分析Fig.10SDS-P
22、AGEanalysisforLIindifferentpurificationsteps图11透射电子显微镜观察的HPV18LI的VLPs形态Fig.11Morphol(yofHPV18VITsobservedbytransmissionelectronicmicroscope3讨论目前,已经上市的HPV疫苗均为真核表达系统所制备,其中Merk的Gardadil采用了酿酒酵母表达系统g,GSK的Cervarix采用昆虫杆状病毒表达系统。采用真核系统表达的HPVL1,较好地保留了蛋白的天然构象和活性,可以在胞内自发形成VLP(9101,但是由于真核表达系统产量低、生产成本高、纯化困难,限制了此类
23、疫苗在第三世界国家中推广应用。大肠埃希菌由于其遗传背景清楚,操作简单且成本低廉,成为克隆和表达外源基因的首选。然而,利用大肠埃希菌系统用于HPVVLP疫苗生产所面临的主要问题在于,大肠埃希菌所表达的L1蛋白大多丧失其天然构象并主要以不溶性包涵体形式存在。虽然通过包涵体纯化、复性等步骤也可得到HPVVLPln,但是在复性过程中重组蛋白大量损失,效率低,难以在商业化生产中应用。因此,可溶性表达非融合HPVL1蛋白成为将大肠埃希菌表达系统应用于HPV疫苗生产的关键问题。为了提高HPV18L1蛋白的可溶性,按照大肠埃希菌密码子偏好,对HPV18L1进行了全基因合成,密码子的适应指数(Codonadap
24、tationindex,CAI)从0.66上调至0.87,增加编码序列中的GC含量,延长mRNA半衰期,去除了mRNA的二级结构,提高翻译起始效率。通过软件对蛋白的亲水性进行预测,最初的165个氨基酸是一个跨膜区域,有很强的疏水性,而连续的疏水性薮基酸的存在不利于蛋白表达,实验中将此段氨基酸截除,然后在27T的低温对阳性重组菌进行诱导表达,低温有助于减慢目的蛋白的表达速度,从而有助于目的蛋白进行正确折叠,增加其可溶性表达皿)。通过上述几方面的优化,最终L1蛋白以可溶形式表达于胞内上清中。由于表达的可溶蛋白含量较低,所以实验中先采用硫酸铉沉淀蛋白,然后再用高盐缓冲液复溶目标蛋白,此方法不仅可以达
25、到富集目的蛋白的目的,而且可以去除一部分杂蛋白,为下游纯化减轻负担。后续通过阳离子交换层析和疏水层析两步纯化方法的联用,目的蛋白的纯度达到了90%以上。但是在表达蛋白的Westernblot检测和纯化后的样品检测中,在相对分子质量约45000处均存在一个降解条带,分析原因可能是胞内蛋白酶对目标蛋白产生降解作用,另外在纯化的过程中,由于室温操作,蛋白也容易发生降解,在后续疫苗开发中将重点解决这一问题。由于表达蛋白以可溶形式存在于细胞裂解上清中,因而避免了尿素、盐酸弧等强烈变性剂对蛋白的变性,维持了蛋白的天然构象,当通过加入后再移走DTT方式,使蛋白去折叠、重折叠,在投射电子显微镜下观察到HPVV
26、LPO有文献报道,HPV的VLP经过解聚、重聚的步骤,将增加颗粒的稳定性、均一性以及抗原性逆。研究所述的利用原核系统进行可溶目的蛋白的表达、纯化以及VLP的形成方法,为进一步评价免疫原性和免疫保护作用,以及生产高纯度的HPV疫苗奠定了基础。参考文献:1:I知aBruni,MireiaDiaz,MireiaCastellsagu,etal.CervicalhumanpapiIIonianni3prevalencein5continents:meta-analysisof1millionwomenwithnormacytologicalfindingsJ.JInfectDis,2010,202(1
27、2):1789-1799.2 VillaLL,SchlegelR.DifferencesintransfonnationactivitybetweenHPV18andHPV16maptotheviralLCR-E6-E7regionJ.Virology,1991,181(1):374-377.3 BonnezW,RoseRC,DaRinC,e/al.Propagationofhumanpapillomavirustype11inhumanxenograftsusingtheseverecombinedimmunodeficiency(SC1D)mouseandcomparisontothenu
28、demousemodelJ.Virology,1993,197(1):455-458.4 KawanaK,AdachiK,KojimaS,etal.Therapeutichumanpapillo-mavirus(HPV)Vaccines:AnovelapproachJ.OpenVirolJ,2012,6(Sup2):264-269.5 KawanaK,YasugiT.TaketaniY.Humanpapillomavirusvaccines:currentissuesandfutureJ.IndianJMedRes,2009,130(3):341-347.6GravittPE.Theknown
29、unknowsofHPVnaturalhistoryJJClin-Invest,2011,121(12):4593-4599.7MunozN,KjaerSK,SigurdssonK,etal.Impactofhumanpapillomavirus(HPV)-6/11/16/18vaccineonallHPV-associatedgenitaldiseasesinyoungwomenJ.JNatlCancerInst,2010,102(5):325-339._8'JoseGarcia-sicilia,TinoF.Schwara,AlfonsoCarmonz,etal.Immunogenicityandsaf
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- GB/T 33644-2025数控板料折弯机精度
- 2025年鄂尔多斯辅警协警招聘考试真题带答案详解
- 2025年玉溪辅警招聘考试真题含答案详解
- 2025年阿克苏辅警协警招聘考试备考题库及答案详解(真题汇编)
- 2025年长治辅警协警招聘考试真题及答案详解(夺冠系列)
- 2025年金华辅警招聘考试题库及答案详解(夺冠系列)
- 2025年贵州辅警协警招聘考试备考题库含答案详解
- 2025年阳江辅警协警招聘考试真题及完整答案详解
- 2025年赤峰辅警协警招聘考试真题及答案详解参考
- 2025年铁岭辅警协警招聘考试真题含答案详解(培优a卷)
- 中国肿瘤药物相关血小板减少诊疗专家共识(2023版)
- 人血清白蛋白-透明质酸纳米颗粒:制备工艺、特性表征与抗肿瘤效能探究
- 超声技术在生物医学工程中的应用
- 医疗机构内部管理规章制度范本范文
- (高清版)DB62∕T 3262-2024 装配整体式叠合混凝土结构技术标准
- 人工智能在口腔颌面影像学中的应用研究-洞察阐释
- 小学科学家长会课件
- 锂电池生产中的潜在安全风险及其控制措施
- 《中国在全球治理体系中的地位》课件
- 长城汽车公司管理制度
- GB/T 24477-2025适用于残障人员的电梯附加要求

评论
0/150
提交评论