



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
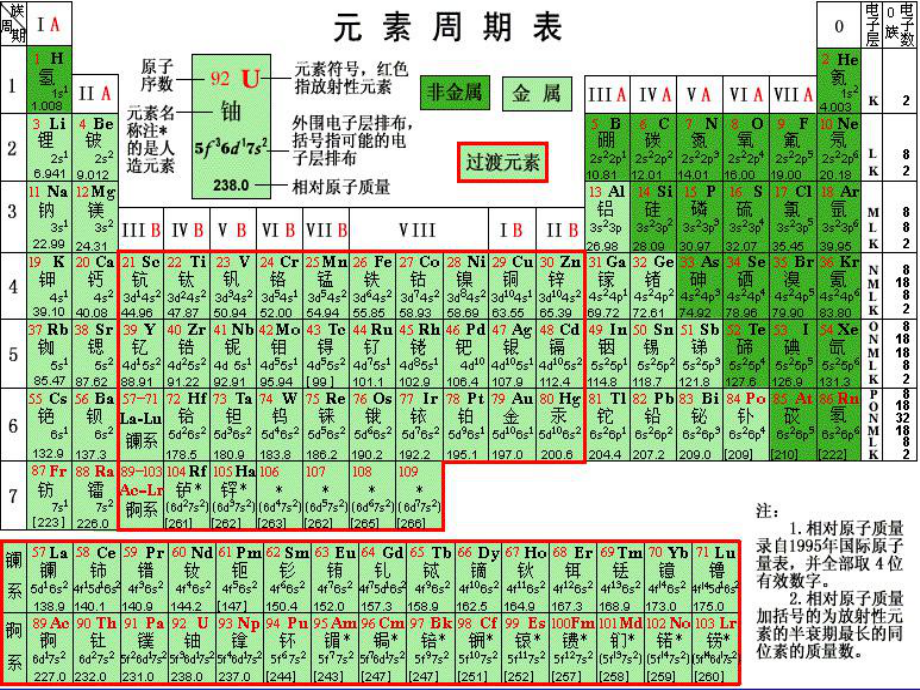
1、第一章第一章 物质结构物质结构 元素周期律元素周期律第一节第一节 元素周期表元素周期表NHeLiBeBCHOFNeNaMgAlSiPSClAr1-181-18号元素的排布号元素的排布问题讨论问题讨论由由118号元素的原子结构分析号元素的原子结构分析1.每一横行有什么相同点?每一横行有什么相同点?2.每一纵行有什么相同点?每一纵行有什么相同点?横行:电子层数相同横行:电子层数相同纵行:最外层电子数相同纵行:最外层电子数相同(He除外除外)原子序数核电荷数质子数核外电子数原子序数核电荷数质子数核外电子数元素周期表的结构元素周期表的结构周期序数周期序数 电子层数电子层数 (1)横行横行周期(周期(7
2、个)个)周期周期长长周周期期第第1周期:周期:第第2周期:周期:第第3周期:周期:第第4周期:周期:第第5周期:周期:第第6周期:周期:不完全周期不完全周期短短周周期期2种元素种元素8种元素种元素8种元素种元素18种元素种元素18种元素种元素32种元素种元素每周期可容纳的元素种类每周期可容纳的元素种类732锕锕89Ac 铹铹103Lr 共共15 种元素称种元素称锕系元素锕系元素, 位于第位于第7周期周期.镧镧57La 镥镥71Lu 共共15 种元素称种元素称镧系元素镧系元素, 位于第位于第6周期周期.注意注意:除第除第1、7周期外周期外,每个周期都是从每个周期都是从碱金属碱金属元元 素开始素开
3、始,逐渐过渡到逐渐过渡到卤素卤素,最后以最后以稀有气体稀有气体元素元素结束结束.超铀元素超铀元素:92号元素铀以后的元素号元素铀以后的元素族族主族主族 (A)副族副族 (B)A , A , A , A ,A , A , A 第第VIII 族:族:稀有气体元素稀有气体元素 零族:零族:共七个主族共七个主族B , B ,B , B , B , B , B共七个副族共七个副族第八、九、十纵行,位于第八、九、十纵行,位于 B 与与B中间中间 (2)纵行纵行( 个个) 族族(16个个)18主族族序数最外层电子数主族族序数最外层电子数 第第VIII 族族小结小结7横,横,18纵;纵;1.元素周期表的结构:
4、元素周期表的结构:三短三长一不全;三短三长一不全;七主七副一八零。七主七副一八零。2.原子结构与表中位置的关系:原子结构与表中位置的关系:周期序数电子层数周期序数电子层数主族序数最外层电子数主族序数最外层电子数练习练习已知某主族元素的原子结构示意图已知某主族元素的原子结构示意图,判断其在周期表中的位置判断其在周期表中的位置第第3周期周期A族族第第4周期周期A族族复习:复习: 1、元素:、元素: 2、原子的构成、原子的构成: 具有相同核电荷数(即核内质子数)的具有相同核电荷数(即核内质子数)的一类原子的总称。一类原子的总称。原子原子原子核原子核核外电子核外电子质子质子 每个质子带每个质子带1个单
5、位正电荷个单位正电荷中子中子 不带电不带电核电荷数质子数核外电子数核电荷数质子数核外电子数,因此,原子因此,原子 呈电中性呈电中性每个电子带每个电子带1个单位负电荷个单位负电荷三、核素三、核素 同位素同位素 1、质量数(质量数(A)质子数()质子数(Z)中子数()中子数(N)XAZ元素符号元素符号质量数质量数 质子数质子数2、核素:具有一定数目的质子和一定数目的、核素:具有一定数目的质子和一定数目的中子的中子的一种原子一种原子。3、同位素:质子数相同而中子数不同的、同位素:质子数相同而中子数不同的同一同一种元素种元素的的不同原子不同原子互称为同位素。互称为同位素。即即:同一元素的不同核素之间互
6、称为同位素同一元素的不同核素之间互称为同位素U: 92U 92U 92U H: 1H 1H 1HC: 6C 6C 6CO: 8O 8O 8O Cl: 17Cl 17Cl12 3 12131416171835 372342352384、注意事项:、注意事项: 元素的种类由质子数决定元素的种类由质子数决定,与中子数、核外电子数,与中子数、核外电子数无关;无关; 核素种类由质子数和中子数共同决定核素种类由质子数和中子数共同决定,与核外电子,与核外电子数无关数无关; 同一元素的各种核素虽然中子数(质量数)不同,同一元素的各种核素虽然中子数(质量数)不同,但它们的化学性质基本相同。但它们的化学性质基本相
7、同。 元素和核素只能论种类,不能论个数;而原子既论元素和核素只能论种类,不能论个数;而原子既论种类,又能论个数;种类,又能论个数; 练习:练习:ab+ dXc+-a b c d各代表什么?各代表什么?a代表质量数;代表质量数;b代表核电荷数;代表核电荷数;c代表离子的电荷数;代表离子的电荷数;d代表化合价代表化合价质量数质量数相对原子质量相对原子质量=cxmm121 构成原子的粒子及其性质构成原子的粒子及其性质质量数将原子核内所有的质子和中子的相对质量将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数。取近似整数值加起来,所得的数值,叫质量数。质量数质量数(A)= 质
8、子数质子数(Z)+ 中子数中子数(N)XAZ元素符号元素符号质量数质量数 核电荷数核电荷数 (核内质子数)(核内质子数)表示原子组成的一种方法 O8162- 2离子电荷离子电荷质量数质量数质子数质子数化化合合价价质量数质量数质子数质子数微粒微粒H 11填表填表中子数中子数电子数电子数23123235451801101616801135Br8035X+2311S2-3216核素核素:具有一定数目的质子和一定数目的中:具有一定数目的质子和一定数目的中子的子的一种原子一种原子。同位素:同位素:质子数相同而中子数不同的质子数相同而中子数不同的同一同一种元素种元素的的不同原子不同原子互称为同位素。互称为
9、同位素。即即:同一元素的不同核素之间互称为同位素同一元素的不同核素之间互称为同位素U: 92U 92U 92U H: 1H 1H 1HC: 6C 6C 6CO: 8O 8O 8O Cl: 17Cl 17Cl12 3 12131416171835 372342352384、注意事项:、注意事项: 元素的种类由质子数决定元素的种类由质子数决定,与中子数、核外电子数,与中子数、核外电子数无关;无关; 核素种类由质子数和中子数共同决定核素种类由质子数和中子数共同决定,与核外电子,与核外电子数无关数无关; 同一元素的各种核素虽然中子数(质量数)不同,同一元素的各种核素虽然中子数(质量数)不同,但它们的化
10、学性质基本相同。但它们的化学性质基本相同。 元素和核素只能论种类,不能论个数;而原子既论元素和核素只能论种类,不能论个数;而原子既论种类,又能论个数;种类,又能论个数; 二、元素的性质与原子结构二、元素的性质与原子结构(一)碱金属元素(一)碱金属元素碱金属元素单质碱金属元素单质RbRb1. 物理性质物理性质总结总结:碱金属的主要物理性质碱金属的主要物理性质 Li Na K Rb Cs1.相似性相似性:2.递变性递变性:1.银白色有金属光泽银白色有金属光泽(铯略带金色铯略带金色)硬度小硬度小,都较柔软都较柔软,有延展性有延展性密度小密度小(石蜡石蜡 Li 煤油煤油 K Na 水水 Rb ClCl
11、2 2BrBr2 2II2 2生成氢化物稳定性:生成氢化物稳定性:HFHClHBrHIHFHClHBrHI卤族元素单质的化学性质的变化规律卤族元素单质的化学性质的变化规律: : (随原子序数的递增)(随原子序数的递增)1.原子半径逐渐增大,原子得电子能力逐渐减弱原子半径逐渐增大,原子得电子能力逐渐减弱2.单质的氧化性逐渐减弱单质的氧化性逐渐减弱3.元素的非金属逐渐减弱元素的非金属逐渐减弱4.单质与氢气反应越来越困难,生成氢化物越来越不单质与氢气反应越来越困难,生成氢化物越来越不稳定稳定元素非金属性强弱判断依据元素非金属性强弱判断依据( (记!记! ) )补补充充1 1、根据单质与氢气反应的难易
12、程度。与氢气反、根据单质与氢气反应的难易程度。与氢气反应越容易,非金属性越强。应越容易,非金属性越强。2 2、根据元素最高价氧化物对应水化物酸性强弱、根据元素最高价氧化物对应水化物酸性强弱。酸性越强,元素的非金属性越强。酸性越强,元素的非金属性越强。3 3、可以根据对应阴离子的还原性强弱判断。阴、可以根据对应阴离子的还原性强弱判断。阴离子还原性越弱,则元素非金属性越强。离子还原性越弱,则元素非金属性越强。 同一主族中,随原子核外电子层数增加同一主族中,随原子核外电子层数增加得电子能力逐渐减弱得电子能力逐渐减弱失电子能力逐渐增强,失电子能力逐渐增强,非金属性逐渐减弱,非金属性逐渐减弱,金属性逐渐
13、增强。金属性逐渐增强。主族元素随原子核外电子层数增加,它们得失主族元素随原子核外电子层数增加,它们得失电子能力、金属性、非金属性递变的趋势。电子能力、金属性、非金属性递变的趋势。思考与交流思考与交流: :规规 律:律:第二节第二节 元素周期规律元素周期规律1 1、核外电子运动特点、核外电子运动特点电子的质量极微小(电子的质量极微小(9.1099.109 1010-31-31kgkg););电子绕核运动是在原子这样极其微小的空间(原子的直电子绕核运动是在原子这样极其微小的空间(原子的直径约径约1010-10-10m m)中进行;)中进行;电子绕核作高速运动(运动的速度接近光速,约为电子绕核作高速
14、运动(运动的速度接近光速,约为10108 8m/sm/s)(4)(4)电子绕核运动没有确定的轨道,不能精确测定或计算电子绕核运动没有确定的轨道,不能精确测定或计算电子在任一时刻所在的位置,也不能描绘出其运动轨迹电子在任一时刻所在的位置,也不能描绘出其运动轨迹, ,我们只能指出它在核外空间某处出现机会的多少。我们只能指出它在核外空间某处出现机会的多少。 这是核外电子运动的根本特征。这是核外电子运动的根本特征。一、原子核外电子的排布一、原子核外电子的排布电电子子云云一、原子核外电子的排布一、原子核外电子的排布2 2、核外电子的能量、核外电子的能量 在含有多个电子的原子里,电子的能量是不同的在含有多
15、个电子的原子里,电子的能量是不同的,它们分别在不同的区域内运动。在离核较近的,它们分别在不同的区域内运动。在离核较近的区域内运动的电子能量较低,在离核较远的区域区域内运动的电子能量较低,在离核较远的区域内运动的电子能量较高。内运动的电子能量较高。我们把我们把不同的区域简化为不连续的壳层称不同的区域简化为不连续的壳层称作作电子层电子层。 ( (洋葱式结构洋葱式结构) )分别用分别用n=1n=1、 2 2、 3 3、 4 4、 5 5、6 6、7 7或或 K K、L L、M M、N N、O O、P P、Q Q3 3、核外电子排布规律、核外电子排布规律(1)(1)电子总是尽可能的从能量低的内层排起,
16、当一电子总是尽可能的从能量低的内层排起,当一层充满后再填充下一层。即先从层充满后再填充下一层。即先从K K层排起然后排层排起然后排L L、M M(2)(2)各电子层最多容纳各电子层最多容纳 个电子个电子(3)(3)最外层不超过最外层不超过 个个(K(K层不超过层不超过2 2个个) ),次外层不,次外层不超过超过 个,倒数第三层不超过个,倒数第三层不超过 个。个。2n2n2 28 818183232原子核外电子排布规律原子核外电子排布规律确定了元素周期表的排布规律与结构特点确定了元素周期表的排布规律与结构特点 请阅读并比较表请阅读并比较表1-21-2中中1 11818号元素的号元素的有关数据,从
17、中能有关数据,从中能找出什么规律?找出什么规律?随着原子序数的递增,随着原子序数的递增,(1)(1)原子的核外电子层原子的核外电子层排布排布, ,(2)(2)元素的原子半径元素的原子半径, ,(3)(3)元素的化合价元素的化合价, ,呈现什么规律性的变化?呈现什么规律性的变化? 1 2 氢氢 氦氦原子原子序数序数元素元素 名称名称 元素元素 符号符号 电子电子排布排布 化合价化合价+ 1 0 HHe 1 2 3 4 5 6 7 8 9 10 锂锂 铍铍 硼硼 碳碳 氮氮 氧氧 氟氟 氖氖 原子原子序数序数元素元素 名称名称 元素元素 符号符号 电子电子排布排布 化合价化合价LiBe B C N
18、 O F Ne2,12,22,32,42,52,62,72,8+ 1 + 2 + 3 + 4- 4+ 5- 3- 2- 10 11 12 13 14 15 16 17 18 钠钠 镁镁 铝铝 硅硅 磷磷 硫硫 氯氯 氩氩 原子原子序数序数元素元素 名称名称 元素元素 符号符号 电子电子排布排布 化合价化合价NaMg Al Si P S Cl Ar2, 8, 12, 8, 22, 8, 32, 8, 42, 8,52, 8, 6 2, 8, 72, 8, 8+ 1 + 2 + 3 + 4- 4+ 5- 3- 2- 10 +6+7原子原子序数序数电子电子层数层数最外层最外层电子数电子数原子半原子半
19、径变化径变化12HHe310LiNe1118NaAr112最高正价:最高正价:+1 +5 21 8负价始于负价始于C , - 4 -1 031 8大大小小大大小小最高正价:最高正价:+1 +7负价始于负价始于Si , - 4 -1 0+1 0最高正化合价、最最高正化合价、最低负化合价的变化低负化合价的变化结论结论:随着原子序数的递增,元素:随着原子序数的递增,元素呈现呈现周期性周期性的变化的变化 为什么随原子序数的递增为什么随原子序数的递增, ,元素元素原子的电子层排布、原子半径、化合原子的电子层排布、原子半径、化合价呈现价呈现周期性周期性变化呢?变化呢? 随原子序数的递增随原子序数的递增,
20、,元素原子元素原子核外核外电子排布电子排布的周期性变化的周期性变化, ,决定了决定了原子半原子半径、化合价呈现径、化合价呈现周期性周期性变化变化。1.1.元素原子的电子层排布规律元素原子的电子层排布规律2.2.原子半径原子半径的变化的变化规律规律3.3.元素化合价的变化规律元素化合价的变化规律 最外层最外层电子数电子数 8 8个个(K(K层是最外层时不超层是最外层时不超2 2个个) ) 次外层次外层电子数电子数 1818,倒数第三层倒数第三层电子数电子数 3232; 随着核电荷数的增加随着核电荷数的增加, 原子核对同一原子核对同一区域区域运动运动 的电子的的电子的吸引吸引力力增大增大, 因此原
21、子半径渐减小因此原子半径渐减小主族主族元素的元素的最高正最高正价价= =族序数族序数=最外层最外层电子数电子数 最高正化合价最高正化合价 + 最低负价最低负价 = 8 元素的金属性和非金属元素的金属性和非金属性是否也随原子序数的变化性是否也随原子序数的变化呈现呈现周期性周期性变化呢?变化呢?金属与水或酸反应越金属与水或酸反应越容容易,金属性越强;易,金属性越强;最高价氧化物对应的水化物(氢氧化物)最高价氧化物对应的水化物(氢氧化物) 碱性越强,金属性越强。碱性越强,金属性越强。金属与某些盐溶液的置换金属与某些盐溶液的置换 元素金属性强弱判断依据元素金属性强弱判断依据: : 金属钠、镁、铝与水反
22、应金属钠、镁、铝与水反应 实验一实验一现象现象化学方程式化学方程式 钠钠与冷水迅速反应,与冷水迅速反应,镁镁与冷水反应缓慢,而与冷水反应缓慢,而镁镁与沸与沸水反应加快,水反应加快,铝铝与冷水不反应与冷水不反应金属性:金属性:NaMgAl结论结论Mg + 2H2O = Mg(OH)2+H2 2Na+2H2O=2NaOH+H2NaOHMg(OH)2 Al(OH)3 金属性:金属性:NaMgAl强碱强碱中强碱中强碱两性氢两性氢氧化物氧化物非金属与非金属与H H2 2化合越化合越容容易,非金属性越强;易,非金属性越强; 气态氢化物越稳定气态氢化物越稳定, , 非金属性越强;非金属性越强; 最高价氧化物
23、对应的水化物(含氧酸)最高价氧化物对应的水化物(含氧酸) 酸性越强,非金属性越强。酸性越强,非金属性越强。非金属与某些盐溶液的置换非金属与某些盐溶液的置换 元素非金属性强弱判断依据元素非金属性强弱判断依据: :氧化物氧化物最高价氧化物的水化物最高价氧化物的水化物 元素元素14Si15P16S17ClSiO2P2O5SO3Cl2O7H2SiO3 H3PO4 H2SO4 HClO4 硅硅 酸酸磷磷 酸酸硫硫 酸酸高氯酸高氯酸弱弱 酸酸中强酸中强酸强强 酸酸更强酸更强酸 非金属性:非金属性:Si P S Cl 非金属性:非金属性:Si P S Cl很不稳定很不稳定不稳定不稳定较不稳定较不稳定稳定稳定
24、 根据实验,可得出第三周期元素金属性、根据实验,可得出第三周期元素金属性、非金属性的递变规律非金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强金属性逐渐减弱,非金属性逐渐增强 对其他周期元素性质进行研究对其他周期元素性质进行研究, ,也可也可以得到类似的结论。以得到类似的结论。 同一周期元素同一周期元素, ,从左到右从左到右, , 金属性逐金属性逐渐减弱渐减弱, ,非金属性逐渐增强。非金属性逐渐增强。 元素的性质随着原子序数元素的性质随着原子序数的递增而呈周期性的变化。的递增而呈周期性的变化。(量变(量变质变)质变)第三节第三节 化学键化学键1.概念要
25、点:概念要点:a. 相邻相邻b.原子原子?之间之间c.强烈作用强烈作用相邻的原子相邻的原子?之间强烈的相互作用之间强烈的相互作用2.化学键主要类型:化学键主要类型:a.离子键离子键b.共价键共价键化学键化学键钠在氯气中燃烧钠在氯气中燃烧现象:现象:剧烈燃烧,剧烈燃烧,黄色火焰,黄色火焰,大量白烟。大量白烟。思考:思考:Na与与Cl是如何结合成是如何结合成NaCl的呢?的呢?NaNa+ +ClCl- -转移转移1e1e不稳定不稳定稳定稳定NaClNaCl形成的微观过程形成的微观过程1. 定义:定义:阴阳离子阴阳离子间通过间通过静电作用静电作用所形所形成的成的化学键化学键称为离子键。称为离子键。一
26、、离子键一、离子键4.离子化合物:由离子键构成的化合物离子化合物:由离子键构成的化合物阴、阳离子阴、阳离子静电引力静电引力2. 构成离子键的粒子:构成离子键的粒子:3. 作用力:作用力:静电作用静电作用斥力斥力成键范围成键范围 活泼金属活泼金属(IA IIA)与非金属与非金属(VIA VIIA)(1)原子原子HOClMgNa三、用电子式表示离子化合物的形成三、用电子式表示离子化合物的形成1.1.电子式电子式:在元素符号周围用小点(或)来表示原 子的最外层电子,这种式子叫电子式电子式。 (2)(2)离子的电子式:离子的电子式:H+Na+Mg2+ O 2 : : Cl : :金属阳离子金属阳离子的
27、电子式就是其的电子式就是其离子符号离子符号。复杂阳离子及阴离子的电子式要标复杂阳离子及阴离子的电子式要标 及及“ 电荷数电荷数 ”。H N H:HH+离子化合物离子化合物: ClNaNaO2-2-NaClMg 2Cl由离子键构成的化合物一定是离子化合物由离子键构成的化合物一定是离子化合物 写出下列粒子的电子式:写出下列粒子的电子式: 硫原子,硫原子, 溴离子,溴离子, 钾离子钾离子 S BrBr - - : :K+氯化钠氯化钠氟化镁氟化镁Na+ Cl - - : : F F - - :Mg2+ F F - - :2、用电子式表示离子化合物的形成过程Mg2BrBrSK KBrMgBrS2-2-
28、K K例例: 1.原子、离子都要标出最外层电子,离子须标明电荷; 2.阴离子要用方括号括起来; 3.相同的原子可以合并写,相同的离子要单个写; 4.不能把“”写成“=”; 5.用箭头标明电子转移方向。书写要点:书写要点:用电子式表示氯化钠的形成过程用电子式表示氯化钠的形成过程 用电子式表示溴化钙的形成过程用电子式表示溴化钙的形成过程 Cl Na Cl -:Na+ Br :Ca Br :Ca2+ BrBr - - : : BrBr - - : : 练习练习 用电子式表示用电子式表示硫化钾硫化钾的形成过程的形成过程 箭头左方相同的原子可以合并箭头左方相同的原子可以合并箭头右方相同的微粒不可以合并箭
29、头右方相同的微粒不可以合并注注意意 S 2K K+ S 2- : :K+不能把不能把“”写成写成“” 思考思考 哪些物质属于离子化合物,含有哪些物质属于离子化合物,含有离子键?离子键? 活泼的金属元素和活泼的非金活泼的金属元素和活泼的非金属属 元素之间形成的化合物。元素之间形成的化合物。如:如:KCl、Na2O、MgCl2、 NH4Cl 、NaOH等等想想 一一 想想 活泼金属与活泼非金属化合活泼金属与活泼非金属化合 时易形成离子键,那么非金属和非金属之间时易形成离子键,那么非金属和非金属之间相互作用时,原子又是怎样结合成分子的?相互作用时,原子又是怎样结合成分子的?H2、HCl是怎样形成的?
30、是怎样形成的?分析氯化氢的形成过程我是非金我是非金属,我很属,我很少失电子少失电子我才不会我才不会失电子给失电子给你你共用电子对共用电子对1、定义:、定义:原子之间通过原子之间通过共用电子对共用电子对所形成的相所形成的相互作用,叫做互作用,叫做共价键。共价键。成键微粒:成键微粒:原子原子成键本质成键本质:共用电子对共用电子对(即原子间的静电作用)(即原子间的静电作用)成键元素成键元素:一般是一般是同种或不同种同种或不同种非金属元素非金属元素三、共价键存在范围存在范围:非金属单质非金属单质(H2、 O2 )、共价化合物、共价化合物(NH3、 CH4 、H2O)、离子化合物、离子化合物(NaOH、
31、 NH4Cl)想想 一一 想想 H2和和HCl的共价键一样么?的共价键一样么? HHee对电子吸引力相同共用电子对共用电子对没有偏向没有偏向HClee对电子吸引力强共用电子对共用电子对偏向偏向Cl2 2、类型、类型(1)极性共价键:共用电子对有偏向)极性共价键:共用电子对有偏向(2)非极性共价键:共用电子对没有偏向)非极性共价键:共用电子对没有偏向两种不同种元素间形成极性共价键,如两种不同种元素间形成极性共价键,如HClHCl等等同种元素间形成非极性共价键,同种元素间形成非极性共价键,如如N2、O2、Cl2等等3 3、影响共价键强弱的因素、影响共价键强弱的因素(1)原子半径)原子半径(2)共用
32、电子对数)共用电子对数原子半径越小,共用电子对数越多,共价键越原子半径越小,共用电子对数越多,共价键越强,则物质的熔沸点越高。强,则物质的熔沸点越高。 判断共价化合物的方法:判断共价化合物的方法:b.b.弱碱(如弱碱(如Cu(OH)Cu(OH)2 2) )、酸、酸( (如如H H2 2SOSO4 4、H H2 2COCO3 3)、非)、非金属氧化物(如金属氧化物(如COCO2 2、SiOSiO2 2) )、气态氢化物、气态氢化物( (如如NHNH3 3、HCl)HCl)、大部分有机物(如大部分有机物(如CH4、C2H5OH)等等属于共价化合物。属于共价化合物。a.a.一般一般是不同的非金属元素
33、之间形成的化合物。是不同的非金属元素之间形成的化合物。思考 哪些物质是共价哪些物质是共价化合物化合物?4.共价化合物:共价化合物:原子间原子间仅仅以共用电子对作用所形成以共用电子对作用所形成的的化合物化合物HF H2O CH4 H F H O HH C HHH(1) 电子式电子式H2 Cl2 N2 注:注: N N (错误)(错误) Cl ClH H5、共价键的表示方法、共价键的表示方法NHHHNH3N N小结小结1、如何确定共用电子对的对数呢?、如何确定共用电子对的对数呢?共用电子对共用电子对对数对数8 - 最外层电子数最外层电子数 COO CO2 2、如何书写共价化合物的电子式?、如何书写
34、共价化合物的电子式?判断哪些元素原子之间形成共用,判断哪些元素原子之间形成共用,判断两原子之间形成几对共用电子对,判断两原子之间形成几对共用电子对,最后补齐各原子上的剩余电子。最后补齐各原子上的剩余电子。几种重要的物质的电子式:几种重要的物质的电子式:NaOHNa2O2NH4ClO H Na+O 2Na+ONa+H2O2OHO H +NHHHHClCl 离子键共价键含有共价键的化合物含有共价键的化合物不一定不一定是共价化合物是共价化合物H2O2Cl2N2HHClClOONN(2)结构式结构式 (单键)(单键) (叁键)(叁键) (双键)(双键) O=C=OO=C=OH HO OH HH HN
35、NH H| |H HCO2NH3H2OCH4H HC CH H| | |H HH H 将一对共用电子对改用一根短线表示将一对共用电子对改用一根短线表示,其余的电子不标出式子。这样的式子叫结构式。,其余的电子不标出式子。这样的式子叫结构式。 物质分子的几种表示方法:物质分子的几种表示方法: 碘碘 6、 用电子式表示下列用电子式表示下列共价分子共价分子的形成过程的形成过程水水 二氧化碳二氧化碳 氨氨 I : I : I :I : :2 H O H O H 硫化氢硫化氢2 H H S H S 3 H N H N H H C O 2 O C O 指出下列化合物所含化学键类型:指出下列化合物所含化学键类
36、型: NaBr、H2S、NaOH、SO2、NH4NO3 属于离子化合物的有属于离子化合物的有 属属属于共价化合物的有属于共价化合物的有 . . 并判断对错:并判断对错: 1 1、含有共价键的化合物一定是共价化合物。、含有共价键的化合物一定是共价化合物。 2 2、共价化合物只含共价键。、共价化合物只含共价键。 3 3、含有离子键的化合物一定是离子化合物。、含有离子键的化合物一定是离子化合物。 4 4、离子化合物只含离子键。、离子化合物只含离子键。 5、只含有共价键的物质一定是共价化合物。、只含有共价键的物质一定是共价化合物。 6、氦气是共价分子。、氦气是共价分子。 7、全部由非金属组成的化合物一
37、定是共价化合物、全部由非金属组成的化合物一定是共价化合物 稀有气体元素结构稳定,是单原子稀有气体元素结构稳定,是单原子分子,没有形成共价键分子,没有形成共价键错(错(NaOH)错(错(N2)对对错错对对错(错(NaOH)NaBr、NaOH、NH4NO3H2S 、SO2错错 NH4Cl研究证实:化学反应中物质变化的实质是研究证实:化学反应中物质变化的实质是旧化学键的断裂和新化学键的形成。旧化学键的断裂和新化学键的形成。共价键与离子键的比较:共价键与离子键的比较:活泼金属活泼金属元素与活元素与活泼非金属泼非金属元素(通元素(通常)常)同种或不同种或不同非金属同非金属元素(通元素(通常)常)成键元素成键元素四、四、分子间作用力和氢键分子间作用力和氢键1、分子间作用力分子间作用力 定义:定义: 把分
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2025水库建设施工合同范本
- 2025【合同范本】私营企业劳动合同模板
- 2025专利权许可使用合同范本
- 2025采购咨询服务合同范本
- 2025设备转让协议书买卖合同
- 2025年青海货运丛业资格证考试题目及答案
- 连云港职业技术学院《房屋建筑学实训》2023-2024学年第一学期期末试卷
- 上海电力大学《国际工程合同管理》2023-2024学年第二学期期末试卷
- 辽宁大连甘井子区育文中学2024-2025学年初三下学期二调考试语文试题含解析
- 江西高安中学2025届高三5月综合质量检测试题物理试题含解析
- 中国话剧史(本二·下)第二讲课件
- 义务兵家庭优待金审核登记表
- GA 255-2022警服长袖制式衬衣
- GB/T 5202-2008辐射防护仪器α、β和α/β(β能量大于60keV)污染测量仪与监测仪
- GB/T 39560.4-2021电子电气产品中某些物质的测定第4部分:CV-AAS、CV-AFS、ICP-OES和ICP-MS测定聚合物、金属和电子件中的汞
- GB/T 3452.4-2020液压气动用O形橡胶密封圈第4部分:抗挤压环(挡环)
- 计划生育协会基础知识课件
- 【教材解读】语篇研读-Sailing the oceans
- 抗肿瘤药物过敏反应和过敏性休克
- 排水管道非开挖预防性修复可行性研究报告
- 交通工程基础习习题及参考答案

评论
0/150
提交评论