



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、.1杂环化合物杂环化合物(heterocyclic compounds).定义:杂环化合物是指构成环的原子除碳原子外还有其定义:杂环化合物是指构成环的原子除碳原子外还有其它原子的环状有机化合物。碳原子以外的原子,称为杂它原子的环状有机化合物。碳原子以外的原子,称为杂原子(原子(heteroatoms),常见的杂原子有氧、硫、氮等。),常见的杂原子有氧、硫、氮等。芳香性杂环:芳香性杂环:(吡咯、吡啶、喹啉等)(吡咯、吡啶、喹啉等)非芳香性杂环:(四氢呋喃、四氢吡咯、六氢吡啶等)非芳香性杂环:(四氢呋喃、四氢吡咯、六氢吡啶等)分类:分类:性质与相应的开链化合物极相似,则不看作是杂环化合物。如环状内
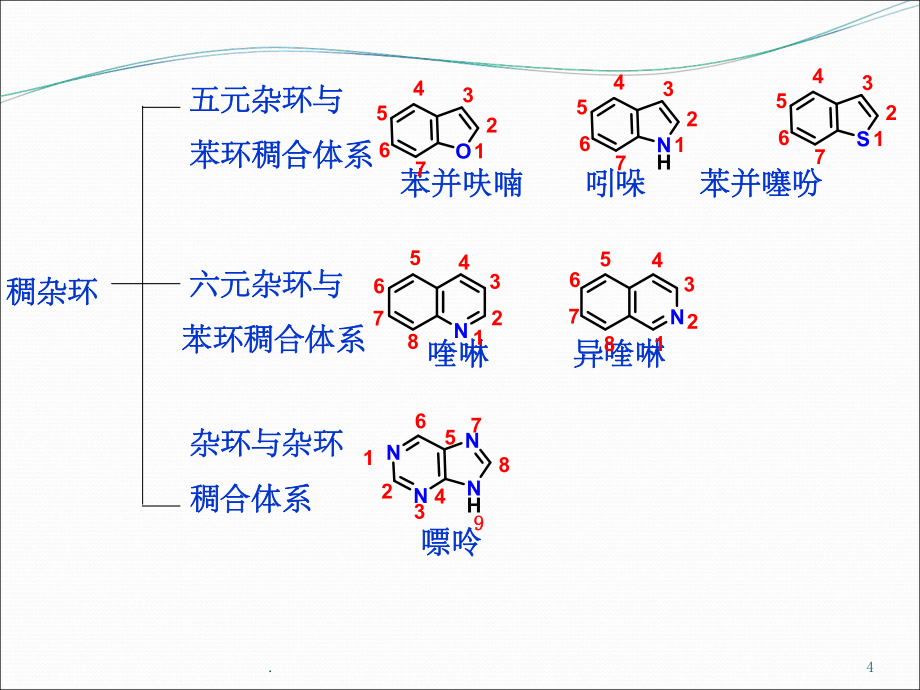
2、酯,性质与相应的开链化合物极相似,则不看作是杂环化合物。如环状内酯,环状环状酸酐、环状酰胺、环醚、环状酰亚胺等。酸酐、环状酰胺、环醚、环状酰亚胺等。.3含一个杂原子含一个杂原子 呋喃呋喃 噻吩噻吩 吡咯吡咯 含二个杂原子含二个杂原子 含一个杂原子含一个杂原子 含二个杂原子含二个杂原子 单单杂杂环环 五元杂环五元杂环 六元杂环六元杂环 咪唑咪唑 吡唑吡唑 噻唑噻唑 噁唑噁唑 吡啶吡啶 -吡喃吡喃 -吡喃吡喃嘧啶嘧啶 吡嗪吡嗪 哒嗪哒嗪 常见杂环化合物的分类、名称常见杂环化合物的分类、名称NNHNHNNSNOOSNHNOONNNNNN.4苯并呋喃苯并呋喃 吲哚吲哚 苯并噻吩苯并噻吩五元杂环与五元杂
3、环与苯环稠合体系苯环稠合体系 六元杂环与六元杂环与苯环稠合体系苯环稠合体系 杂环与杂环杂环与杂环稠合体系稠合体系 喹啉喹啉 异喹啉异喹啉 嘌呤嘌呤稠杂环稠杂环 634521NH7634521O7634521S7125345NN1234678867634521NNHNN9 987.命名命名1、音译法(带、音译法(带“口口”旁的同音汉字)旁的同音汉字)2、当环上连有烷基、硝基、卤素、羟基、氨基等取代基时,当环上连有烷基、硝基、卤素、羟基、氨基等取代基时,以以杂环为母体杂环为母体; 当环上当环上连有醛基、羧基、磺酸基等时,将杂连有醛基、羧基、磺酸基等时,将杂环作为取代基环作为取代基。3、编号编号从杂
4、原子算起依次用从杂原子算起依次用1,2,3,4,5编号。(用编号。(用,则从杂原子相邻的碳原子依次编号)则从杂原子相邻的碳原子依次编号),如有不同种类如有不同种类杂原子,则按杂原子,则按O,S,N的顺序由小到大编号,的顺序由小到大编号,使杂原子尽可使杂原子尽可能具有较低的编号。能具有较低的编号。.OCHONCOOHNNNH2 5-乙基噻唑乙基噻唑 2-甲基甲基-5-苯基噁唑苯基噁唑 4,5-二甲基嘧啶二甲基嘧啶2-呋喃甲醛呋喃甲醛 3-吡啶甲酸吡啶甲酸 4-氨基嘧啶氨基嘧啶NOCH3C6H5NSC2H5NNCH3H3C.一、结构一、结构 呋喃呋喃 吡咯吡咯 噻吩噻吩杂原子(杂原子(O、S、N)
5、杂化态均为)杂化态均为sp2杂化杂化ONS呋喃、吡咯和噻吩呋喃、吡咯和噻吩符合符合Hckel规则(规则(1. 环状环状, 2. 共平面共平面, 3. 垂直平面的垂直平面的p轨道轨道, 4. 4n+2 p电子电子 具有方向性具有方向性.二、吡咯、呋喃和噻吩的性质二、吡咯、呋喃和噻吩的性质物理性质物理性质 1、光谱性质、光谱性质 1HNMR:H 7 2、芳香性比较:、芳香性比较:苯苯噻吩噻吩吡咯吡咯呋喃呋喃 电负性影响:一般来说,杂原子与碳原子的电负性越接电负性影响:一般来说,杂原子与碳原子的电负性越接近,其相应的五元芳香杂环的芳香性越强,其共轭能也越近,其相应的五元芳香杂环的芳香性越强,其共轭能
6、也越大。大。 元素元素 S N O C电负性:电负性:2.5 3.0 3.5 2.5芳香性:芳香性: 噻吩噻吩 吡咯吡咯 呋喃呋喃共轭能:共轭能: 苯苯 吡咯吡咯 噻吩噻吩 呋喃呋喃KJ.mol- 1 50 121.1 88.7 66.1.CCCCAHHHH 杂原子的性质杂原子的性质 杂原子对环的影响杂原子对环的影响ONHS 芳香性芳香性 共轭二烯性质共轭二烯性质 不饱和性不饱和性A.1、 五员芳杂化合物的亲电取代反应五员芳杂化合物的亲电取代反应亲电取代反应相对活性亲电取代反应相对活性NHOS310186101151091 吡咯吡咯 呋喃呋喃 噻吩噻吩 苯苯吡咯、呋喃、噻吩上吡咯、呋喃、噻吩上
7、吸电子诱导效应:吸电子诱导效应: O(3.5)N(3.0)S(2.5)给电子共轭效应:给电子共轭效应:NOS(S的的3p轨道与轨道与C的的2p轨轨道共轭相对较差道共轭相对较差)综合:综合:N对环的贡献的电子最多,硫最少。对环的贡献的电子最多,硫最少。i.电子云密度电子云密度. ii. 由中间体的稳定性分析由中间体的稳定性分析AEH H+AEAE+ 取代E+E- H+EH比较:苯的亲电取代比较:苯的亲电取代满足八隅体满足八隅体(较稳定)(较稳定)未满足八隅体未满足八隅体(较不稳定)(较不稳定).AE+AEAE+ +-取代取代-取代取代主要产物主要产物 取代位置取代位置AE+AEAEAE贡贡献献最
8、最大大(满满足足八八隅隅体体) 取代HAEAEAE+H贡贡献献最最大大(满满足足八八隅隅体体)-取代反应中间体的相对稳定性反应中间体的相对稳定性二个主要共振式不稳定二个主要共振式不稳定三个主要共振式稳定三个主要共振式稳定. 亲电取代反应举例亲电取代反应举例注意:注意:五员杂环较活泼,遇酸不稳定五员杂环较活泼,遇酸不稳定A强强酸酸氧氧化化聚聚合合分分解解反反应应剧剧烈烈(吡吡咯咯,呋呋喃喃,噻噻吩吩)硝化:硝化:HNO3/H2SO4磺化:磺化:H2SO4用温和试剂代替用温和试剂代替.(1) 五员杂环的硝化反应五员杂环的硝化反应AcONO2AcONO2+硝化试剂硝化试剂NHAcONO2Ac2O,
9、10oCNHNO2SAcONO2Ac2O-AcOH, 0oCSNO260% 吡咯和噻酚发生正常亲电取代反应吡咯和噻酚发生正常亲电取代反应. 呋喃发生加成反应(特殊,共轭烯烃性质)呋喃发生加成反应(特殊,共轭烯烃性质)OAcONO2 5 30oCONO2AcO碱 或ONO2 HOAc加成消除OONO2AcOHHBONO2AcOONO2NO2 HOAc+机理:机理:.磺化试剂:磺化试剂:(2) 五员杂环的磺化反应五员杂环的磺化反应NSO3(吡啶 SO3加合物)NH100oCNHSO3HSSH+r. t.SO32Ba2+OH+OSO3H41%90%86%Ba(OH)2NSO3NSO3NSO3r. t
10、.噻吩还可直接用硫酸磺化(活性大,较稳定)噻吩还可直接用硫酸磺化(活性大,较稳定)应用:除去苯或甲苯中的噻吩应用:除去苯或甲苯中的噻吩SSSO3HH2SO4r. t.S(少量)H2SO4r. t.SSO3H溶解于硫酸中反应快&.OOCSSCH3OPhCClO(较弱的Lewis酸)PhCOSnCl2Ac2OBF3OBr2 / 0oC稀溶液OBrSSBrHOAcBr2,活性大,直接反应,不加路易斯酸活性大,直接反应,不加路易斯酸 卤代(稀释或低温控制在一卤代)卤代(稀释或低温控制在一卤代) FriedelCrafts反应反应NHNHCCH3Ac2OONHBr2 / 0oC乙乙醇醇NHBr,
11、BrBrBr.环上已有取代基对亲电取代取向的影响环上已有取代基对亲电取代取向的影响由取代基和环上杂原子的由取代基和环上杂原子的-定位效应决定定位效应决定 位位有有取取代代基基无无论论给给电电子子基基还还是是吸吸电电子子基基吸吸电电子子基基OXWAGAW给给电电子子基基吸吸电电子子基基 位位有有取取代代基基E EX=S, ,N N给给电电子子基基XG. 反应举例反应举例 位给电子基位给电子基 位吸电子基位吸电子基SCH3HNO3 / Ac2OSCH3SCH3O2NNO2+70%30%SNO2HNO3SNO2SNO2O2NO2N+85%15%ONO2HNO3ONO2O2N(AcONO2)主要产物(
12、例外).SHNO3 / Ac2OSNO2BrSBr2BrCOOHCH3COOHSCOOHBr 位给电子基位给电子基 位吸电子基位吸电子基. (i) 位有位有给电子基给电子基从中间体稳定性分析取代基对反应取向的影响从中间体稳定性分析取代基对反应取向的影响AG345E+进入3位进入4位进入5位AGEAGEAGEAGEAGEAGEAGEE+E+ 二个共振式二个共振式 推电子基使推电子基使 稳定稳定 二个共振式二个共振式 推电子基未推电子基未 起作用起作用 三个共振式三个共振式 推电子基使推电子基使 稳定稳定较稳定较稳定不稳定不稳定最稳定最稳定. (ii) 位有位有吸电子基吸电子基 二个共振式二个共振
13、式 吸电子基使吸电子基使 不稳定不稳定 二个共振式二个共振式 吸电子基未吸电子基未 起作用起作用 三个共振式三个共振式 推电子基使推电子基使 不稳定不稳定AW345E+进入3位进入4位进入5位AWEAWEAWEAWEAWEAWEAWEE+E+较稳定较稳定不稳定不稳定最稳定最稳定. (iii) 位有位有给电子基给电子基AG245E+进入2位进入4位进入5位AGEE+E+AGEAGEAGEAGEAGEAGEAGE 三个共振式三个共振式 推电子基使推电子基使 稳定稳定 二个共振式二个共振式 推电子基未推电子基未 起作用起作用 三个共振式三个共振式 推电子基未推电子基未 起作用起作用较稳定较稳定不稳定
14、不稳定最稳定最稳定.AW245E+进入2位进入4位进入5位AWEE+E+AWEAWEAWEAWEAWEAWEAWE (iv) 位有位有吸电子基吸电子基 三个共振式三个共振式 吸电子基使吸电子基使 不稳定不稳定 二个共振式二个共振式 吸电子基未吸电子基未 起作用起作用 三个共振式三个共振式 吸电子基未吸电子基未 起作用起作用较稳定较稳定不稳定不稳定最稳定最稳定.OSNHH2 / PdH2 / PdOSNHH2 / MoS2五员芳杂环的其它反应五员芳杂环的其它反应(1) 还原成饱和杂环化合物还原成饱和杂环化合物使用特殊催化剂使用特殊催化剂(噻吩能使常用(噻吩能使常用氢化催化剂中毒)氢化催化剂中毒)
15、THF(常用溶剂)(常用溶剂)四氢吡咯四氢吡咯. 用用Raney Ni催化氢化使噻酚还原脱硫催化氢化使噻酚还原脱硫其它脱硫的例子其它脱硫的例子SRRRRNiSSCCORORRaney NiRaney NiH2H2CCOROR+NiS+RCRORCRSSSHHSRCRHHH2Raney Ni一种还原羰基至亚一种还原羰基至亚甲基的方法甲基的方法.(2) Diels-Alder反应(共轭二烯性质)反应(共轭二烯性质)O+CO2CH3CO2CH3OCO2CH3CO2CH3FBrLiOONHHN.(3) 呋喃的几个特殊反应呋喃的几个特殊反应(i) 2, 5-二取代呋喃的酸性开环反应(成二取代呋喃的酸性开
16、环反应(成 1, 4-二酮)二酮)合成上进一步应用合成上进一步应用制备环戊烯酮衍生物制备环戊烯酮衍生物ORCH2CH2RH2O / H+ORCH2CH2RORRCH2OOHORRH2O / H+ORROONHS共共振振能能(kcal/mol)1621222936 呋喃的芳香性较小呋喃的芳香性较小. 呋喃酸性开环机理呋喃酸性开环机理:ORRH+ORRHHORRORROH2OHRROHOHRROHOHRRO- - H+H+OHRROORROH2O- - H+.(ii) 呋喃的加成反应(呋喃的共轭二烯性质)呋喃的加成反应(呋喃的共轭二烯性质)例:与例:与AcONO2的反应(前面已介绍):的反应(前面
17、已介绍):SAcONO2Ac2O-AcOH, 0oCSNO2SNO260%10%+OAcONO2 5 30oCONO2AcO碱 或ONO2 HOAc加成消除取取代代比较比较OBr2 / CH3OHOH3COBrCH3OHOH3COOCH3. 2, 5-二甲氧基二氢呋喃的形成机理:二甲氧基二氢呋喃的形成机理:Br2+2 CH3OHCH3O+Br CH3Br+H2OOBrOBrCH3OOBrH3CO BrOH3COOH3COOCH3OCH3. 合成上的应用举例合成上的应用举例OBr2 / CH3OHOH3COBrCH3OHOH3COOCH3H2 / PdOH3COOCH3H2OH+OHOH琥珀醛1
18、, 4-丁二醛.吡咯的一些特殊性质吡咯的一些特殊性质 (1)吡咯吡咯N 的孤对电子参与环的共轭的孤对电子参与环的共轭吡咯吡咯N的碱的碱性很弱,不能与质子结合。性很弱,不能与质子结合。 吡咯碱性吡咯碱性比苯胺弱,而还原后的四氢吡咯的碱性比苯胺弱,而还原后的四氢吡咯的碱性比吡咯的碱性强得多。比吡咯的碱性强得多。吡咯的质子化发生在环上(主要是吡咯的质子化发生在环上(主要是 位)位)NHH+NHHHNHHHNHHH正电荷分散在多个原子上正电荷分散在多个原子上R3NNKb10-410-14H.(2)吡咯在酸性条件下发生聚合)吡咯在酸性条件下发生聚合聚合机理聚合机理:NHnH+NHHHnNHH+NHHHN
19、HNHHHNHHNHHHNHHNHHNHHHHNHHHn.(3) 吡咯吡咯N-H的弱酸性的弱酸性吡咯盐的生成吡咯盐的生成NHNK+KH2NHpKa17.5NRRH 35ROH17PhOH10Na, K, KOH,NaNH2NHN+CH3CH2MgBrMgBrCH3CH3.(4) 吡咯钾盐的性质吡咯钾盐的性质吡咯负离子吡咯负离子 的结构特点的结构特点NN有烯胺负离子片断有烯胺负离子片断烯胺烯胺ON吡咯负离子与吡咯负离子与苯氧基负离子苯氧基负离子有相似性有相似性烯醇负离烯醇负离子片断子片断烯胺负离烯胺负离子片断子片断.吡咯负离子的一些典型反应吡咯负离子的一些典型反应NKCO2H2OH+NHCOOH
20、CHCl3KOHNHCHORCClONCOR150oCNHCORCH3INCH3150oCNHCH3这些反应与这些反应与那几个反应那几个反应相似?相似? 与重氮盐偶联与重氮盐偶联NHNN PhPhN2 X. 几个相似的反应几个相似的反应(酚类的反应)(酚类的反应)OAlCl3OHCROCROOHCRO+ONaOHCO2H+OHCO2H加压CO2OHOHOHCHO+OHCHOCHCl3Reimer-Tiemann反应Kolbe-Schmitt反应Fries重重排排. 呋喃、吡咯和噻吩环的制备方法,常采用呋喃、吡咯和噻吩环的制备方法,常采用1,4-二羰二羰基化合物为原料。基化合物为原料。5. 呋喃
21、、吡咯和噻吩环的制法呋喃、吡咯和噻吩环的制法H2CC CCH2H3CCH3OCH3H3CNHCH3H3CSCH3H3CP2O5P2S5100(NH4)2SO4或NH3,OO. 吡咯环还常用吡咯环还常用克诺尔(克诺尔(knorr)合成法来合成,合成法来合成,此法是由此法是由-氨基酮与氨基酮与-二羰基化合物(如二羰基化合物(如-酮酸酯)酮酸酯)发生缩合反应。发生缩合反应。H2C NH2H3CCOH2C COOC2H5COCH3H+NHCH3COOC2H5H3C+-氨基酮与氨基酮与-二羰基化合物二羰基化合物.呋喃的衍生物呋喃的衍生物糠醛糠醛OCHOOCHO浓OHKCN(CH3CO)2OCH3COON
22、aOCH2OHOCOOH+OCHCOH OOOC CHHCOOH.第二节第二节 含两个杂原子的五元杂环含两个杂原子的五元杂环 环中含有二个杂原子的体系称为环中含有二个杂原子的体系称为唑(唑(azole),),根根据杂原子的位置不同,可以分为据杂原子的位置不同,可以分为1,2-唑与唑与1,3-唑。当杂唑。当杂环化合物含有不同的杂原子时,按氧、硫、氮的顺序环化合物含有不同的杂原子时,按氧、硫、氮的顺序编号,并使杂原子的编号最小。编号,并使杂原子的编号最小。NNHNSNO1123451234512345ONSN12345NHN23451234511,2-唑唑1,3-唑唑异噁唑异噁唑 异噻唑异噻唑 吡
23、唑吡唑 噁唑噁唑 噻唑噻唑 咪唑咪唑 . 咪唑的分子结构 NNH. 在噁唑、异噁唑分子中,由于氧原子的吸电子效应,使氮在噁唑、异噁唑分子中,由于氧原子的吸电子效应,使氮原子供电能力减弱,故碱性下降,尤其是异噁唑的碱性最弱。原子供电能力减弱,故碱性下降,尤其是异噁唑的碱性最弱。咪唑具有较高的碱性,具有对称的共轭酸,共轭是正电荷分布咪唑具有较高的碱性,具有对称的共轭酸,共轭是正电荷分布均匀,稳定性提高。均匀,稳定性提高。pKa -2.03 1.3 2.4 2.5 7.0 ONH+NH+ONH+SNHNH+NH+NH唑中的氮原子在其唑中的氮原子在其sp2杂化轨道中有一对孤对电子,杂化轨道中有一对孤对
24、电子,因此具有碱性,但比一般的胺弱。因为因此具有碱性,但比一般的胺弱。因为 sp2比比sp3杂杂化轨道化轨道s成分多,离核近。成分多,离核近。NH+NHNHNH. 1,3-唑及唑及1,2-唑与呋喃、噻吩、吡咯类似,都可以发生亲电唑与呋喃、噻吩、吡咯类似,都可以发生亲电取代反应,但由于唑分子中增加了一个吸引电子的氮原子,降取代反应,但由于唑分子中增加了一个吸引电子的氮原子,降低了环上的电子云密度,因而唑的亲电取代的反应活性较呋喃、低了环上的电子云密度,因而唑的亲电取代的反应活性较呋喃、噻吩、吡咯为低。噻吩、吡咯为低。1,2-唑与唑与1,3-唑的亲电取代反应的活性顺序有:唑的亲电取代反应的活性顺序
25、有: 1,2-唑 1,3-唑 NNHNSNONHNSNON. 唑发生亲电取代反应时,取代的位置与呋喃、噻吩、吡咯有唑发生亲电取代反应时,取代的位置与呋喃、噻吩、吡咯有所差别。所差别。1,2-唑取代位置都在唑取代位置都在4-位位,1,3 唑中咪唑环的取代位置也唑中咪唑环的取代位置也在在4-位,而位,而噻唑环噻唑环的取代位置都以的取代位置都以 5-位位为主。为主。NHNNHNBrBr2AcOH-H2OONSNONSNO2NHO3SHNO3,H2SO4浓H2SO4,SO3.NNHNNHO2NHNO3,H2SO4DNHNO2NNSNNHNSNNHBrHO3SBr2,CHCl3发烟H2SO4HgSO4N
26、HNBr.第三节第三节 含一个杂原子的六员芳杂化合物(吡啶)的性质含一个杂原子的六员芳杂化合物(吡啶)的性质吡啶的结构吡啶的结构N共振能:共振能:23卡卡/molCCCCCNHHHHHsp2轨道轨道.象叔胺象叔胺有亲核性和碱性有亲核性和碱性N可被氧化可被氧化 吡啶性质的初步分析吡啶性质的初步分析N亚胺结构片断亚胺结构片断有亲电性有亲电性与亲核试剂反应与亲核试剂反应不饱和性不饱和性可加氢还原可加氢还原与苯相似与苯相似有芳香性有芳香性可亲电取代可亲电取代.1 吡啶的碱性和亲核性吡啶的碱性和亲核性(1) 碱性碱性 合成上作为有机碱合成上作为有机碱Knoevenagel反应反应NR3NNKb10-91
27、0-410-14HROTs+TsClNROH+NH ClRCH+NC(CO2C2H5)2RCHOCH2(CO2C2H5)2脂肪胺脂肪胺吡啶吡啶苯胺苯胺吡咯吡咯由于由于N上的电子未参与共轭,具有碱性,孤电子对在上的电子未参与共轭,具有碱性,孤电子对在sp2杂化轨道中,杂化轨道中,孤电子对的孤电子对的s成分高,不易给出电子,接受质子的能力弱,为弱碱,成分高,不易给出电子,接受质子的能力弱,为弱碱,比脂肪胺弱,比芳胺强。比脂肪胺弱,比芳胺强。. 其它应用其它应用制备吡啶盐试剂制备吡啶盐试剂如磺化试剂如磺化试剂NNSO3SO3(2)亲核性)亲核性 吡啶的烷基化吡啶的烷基化N-甲基吡啶盐的重排甲基吡啶盐
28、的重排NCH3NCH3II+N-甲基吡啶盐甲基吡啶盐NCH3300oCHINaOHNCH3NCH3HINCH3NaOH重排NCH3I. 吡啶的酰基化及其应用吡啶的酰基化及其应用NRCClONRCOCl作为酰基化试剂ROHRCORONClH+NRCOROHNRCOORHRCOORHN+吡啶充当一个好的离去基团RCORONH+酰基化机理酰基化机理.2. 吡啶环上的亲电取代吡啶环上的亲电取代 待解答的两个问题待解答的两个问题:NENNNEEEoror 取取代代 取取代代 取取代代取代位置:取代位置:哪个为主?哪个为主?反应活性:反应活性:比苯快比苯快? 还是比苯慢还是比苯慢?.吡啶的亲电取代反应的活
29、性比苯弱吡啶的亲电取代反应的活性比苯弱,类似硝基苯类似硝基苯,亲电取代反应总是发生亲电取代反应总是发生在在3位或位或5位位(-位位),吡啶环上由给电子基时吡啶环上由给电子基时,亲电取代反应活性增强。亲电取代反应活性增强。NNO2吡啶吡啶 (N吸电子能力较强),吸电子能力较强), 为缺电子芳杂环,故比苯难亲电取为缺电子芳杂环,故比苯难亲电取代,和硝基苯相似代,和硝基苯相似.66只有在极强的条件下才能发生硝化、磺化及卤化反应。但不只有在极强的条件下才能发生硝化、磺化及卤化反应。但不发生发生F-C烷基化、酰化反应;吡啶环上有烷氧基,氨基等给烷基化、酰化反应;吡啶环上有烷氧基,氨基等给电子基时,有助于
30、亲电取代反应的进行,但反应活性仍低于电子基时,有助于亲电取代反应的进行,但反应活性仍低于相应的苯系化合物;相应的苯系化合物;.N发烟 H2SO4发烟 HNO3 /无反应发生发烟 H2SO4发烟 HNO3 /NNO2300oC / 24hN(CH3)3发烟 H2SO4发烟 HNO3 /N(CH3)3NO2钝化钝化 取代取代起强吸电起强吸电子基作用子基作用对比:对比:.其它钝化现象其它钝化现象有给电子基时反应较易进行有给电子基时反应较易进行NNSO3HNBr浓 H2SO4 / HgSO4220oC300oCBr2 / 浮石无反应发生Friedel-Crafts 反应NKNO3 / 浓 H2SO41
31、10oCNNO2H3CCH3H3CCH3NNH220oCBr2 / HOAcNNH2Br.N EE(i) 由吡啶的共振式分析由吡啶的共振式分析:结论结论: 1. 环上带正电环上带正电, 不利于亲电取代不利于亲电取代 2. 位的正电荷密相对较低(较位的正电荷密相对较低(较 易反应的位置易反应的位置 对反应取向及钝化现象的解释对反应取向及钝化现象的解释NNNNNN EE. (ii) 由反应的中间体稳定性分析由反应的中间体稳定性分析 取代在取代在 位位不稳定不稳定正电荷在电负性正电荷在电负性大的原子上大的原子上中间体有中间体有两个两个主要共振式主要共振式NENENENEHHH- - H+NE 位位.
32、E 位位NNEHNEHNEH- - H+NE 取代在取代在 位位中间体有中间体有三个三个主要主要共振式,共振式,较稳定较稳定. 取代在取代在 位位ENNEHNEHNEH- - H+NE不稳定不稳定正电荷在电负性正电荷在电负性大的原子上大的原子上中间体有两个主要共振式中间体有两个主要共振式(与(与 位反应类似)位反应类似).3. 吡啶环上的亲核取代反应吡啶环上的亲核取代反应 NNuNNHNuNNuNu = NH2, PhNu H通过氧化去氢通过氧化去氢或或与与负氢负氢接受体结合接受体结合亚胺片断亚胺片断亲核加成亲核加成负氢消除过程负氢消除过程.(1) NaNH2与吡啶的亲核取代与吡啶的亲核取代
33、反应反应机理机理:NNNH2+NaNH2H2NH3 或 PhNMe2NNH2NHNH2HNH2NNH2+HHNNHH或NNH2+NHN+HHNH2NNH+NH3NH2.(2) PhLi 与吡啶的亲核取代与吡啶的亲核取代NPhLiNPhO2 or PhNO2,(氧化).(3) 或或 位有离去基团时的亲核取代位有离去基团时的亲核取代(与硝基苯类似,取代易进(与硝基苯类似,取代易进行)行)NClNOHNaOHNHO -吡啶酮异构化NHO(仍有芳香性)NClNOHCl ClNOHOHNNH2(1)NaNO2, HCl(2)H2O,NOHNHO异构化NNaNH2机理:机理: 制备制备 -吡啶酮的其它方法
34、吡啶酮的其它方法例:例:好离去基好离去基.其它取代例子其它取代例子NNH2NClNH3, ZnCl2(a)NClPhNH2NNHPh(b)NBrNH3NNH2BrBrNOCH3NClNaOCH3 HOCH3(c)(d).4. 吡啶的还原和氧化吡啶的还原和氧化(1) 还原还原吡啶环比苯环易被还原吡啶环比苯环易被还原NH2, Pt0.3 MPNHNNHNHSn / HClor Na / EtOHH2, Ni喹啉1, 2, 3, 4-四氢喹啉十氢喹啉.NH2O2HOAcNON-氧化吡啶(2) 氧化氧化 氧化在侧链上氧化在侧链上NCH3KMnO4NCOOHNNCH3NCOOH尼古丁(烟碱)烟酸HNO3
35、 氧化在氧化在 N 上上R3NH2O2R3NO胺氧化合物对比:对比:吡啶的抗氧化能力比苯强,只氧化侧链。吡啶的抗氧化能力比苯强,只氧化侧链。.5. N-氧化吡啶的性质氧化吡啶的性质(1) 有亲电性有亲电性(易与亲电试剂发生亲电取代,取代在(易与亲电试剂发生亲电取代,取代在4位)位)NO发烟HNO3发烟H2SO490oCNONO2主要产物NNO2POCl3+PCl3N发烟 H2SO4发烟 HNO3 /NNO2300oC / 24h对比:对比:反应活性不同反应活性不同取代位置不同取代位置不同.NO(1) PhMgX(2) H2ONOHPhHAc2ONPhNPhLiNPhO2 or PhNO2,(氧
36、化)(2) 有亲核性有亲核性(易与亲核试剂进行亲核加成)(易与亲核试剂进行亲核加成)对比:对比:反应较快反应较快.为什么为什么N-氧化吡啶氧化吡啶既有亲电性又有亲核性?既有亲电性又有亲核性?(i)NONONONOONO 结构上有相似性结构上有相似性邻对位负电邻对位负电荷密度较大荷密度较大(1)N-氧化吡啶有两种形式的共振式氧化吡啶有两种形式的共振式.保留吡啶的特点保留吡啶的特点邻对位正电荷密邻对位正电荷密度较大度较大NONONONON(ii)NO 结构上有相似性结构上有相似性.NONOHNO2NOHNO2八隅体,稳定NONO2 H+NONO2PCl3NNO2+OPCl3NO2PCl3(2) 反
37、应的中间体较稳定反应的中间体较稳定(i) 亲电取代机理亲电取代机理.NOPhMgXNOMgXPhHH2ONOHPhHAc2ONOAcPhH HOAcNPh(ii) 亲核加成及进一步机理亲核加成及进一步机理比较稳定比较稳定亲电性较强亲电性较强.(3)还原反应)还原反应NNHH2/Ni加加压压六六氢氢吡吡啶啶又又称称哌哌啶啶.6. 吡啶吡啶 2 2和和 4 4位侧链上的反应位侧链上的反应 吡啶吡啶 2 2和和 4 4位的位的 氢氢 有弱酸性有弱酸性醛酮的类醛酮的类似性质似性质有有亲核性亲核性NCH2BHNCH2NCH2NH2CHBNCH2NCH2ORCH2BHORCH2ORCH2OH2CHBROC
38、H2ROCH2R对比对比烯醇负离子烯醇负离子共轭烯醇共轭烯醇负离子负离子.反应举例反应举例:(1) 与醛酮加成与醛酮加成机理:机理:NCH3Ph C PhONCH2NCH2NH2NCH2HPhCPhOH2ONaNH2PhCPhOHNCH2PhCPhONCH2PhCPhOH类似于醛酮类似于醛酮的什么反应?的什么反应?.(2) Michael加成加成(3) 烷基化烷基化NCH2CH3CH3NCH2CH3CH2CH3NCH2CH3CH2NaNH2CH3INCH3N RLiCNCNNCH21.2. H2O.(4) Lewis 酸作用下的加成反应酸作用下的加成反应NCH3H CHONCH2CH2OHZn
39、Cl2NCH3ZnCl2NCH2ZnClClHNCH2ZnClH CHONCH2ZnClCH2OH2O HClNCH2CH2OH机理:机理:Lewis 酸加强酸加强了了 氢的酸性氢的酸性.第四节第四节 含一个杂原子的含一个杂原子的苯并五员杂环苯并五员杂环体系体系三种苯并五员杂环体系三种苯并五员杂环体系亲电取代反应:亲电取代反应:NHOS123456712345671234567吲哚吲哚苯并呋喃苯并呋喃苯并噻吩苯并噻吩AEAEAEor芳香性比苯环差芳香性比苯环差负电荷密度校大负电荷密度校大.亲电取代中间体分析:亲电取代中间体分析:苄基型正碳离子苄基型正碳离子(有两个主要共振式)(有两个主要共振式
40、)满足八隅体满足八隅体 两种中间体均有两种中间体均有一定的稳定性一定的稳定性(一个主要共振式)(一个主要共振式)AEAEAEHAEAEAEHHAE- H+- H+2-位3-位.亲电取代反应举例:亲电取代反应举例:NHN SO3NHSO3HSNHCOCH3Ac2O主要产物+ 2位取代产物OHNO3HOAcONO2AlCl3NSO3HOHNO2少量取向类似取向类似取向不同取向不同.第五节第五节 含一个杂原子的苯并六员杂环体系含一个杂原子的苯并六员杂环体系喹啉和异喹啉:喹啉和异喹啉:N12345678N12345678亲电取代(反应取向)亲电取代(反应取向)氧化和还原反应氧化和还原反应结构和性质分析结构和性质分析喹啉喹啉异喹啉异喹啉碱性和亲和性碱性和亲和性亲电取代亲电取代亲核取代亲核取代氧化和还原反应氧化和还原反应支链上的反应支链上的反应象吡啶(杂
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2025年德阳市什邡市妇幼保健院医护人员招聘考试试题及答案解析
- 系统性硬化症血管纤维化个体化策略
- 系统性硬化症的纤维化抑制策略
- 糖酵解-线粒体耦联调控T细胞活化
- 糖网病早期玻璃体黄斑界膜改变的意义
- 2025江苏经贸职业技术学院招聘26人备考题库(第二批)及完整答案详解
- 2025河南漯河市住房和城乡建设局所属事业单位人才引进1人备考题库附答案详解
- 2025年漯河市城乡一体化示范区事业单位人才引进7人备考题库带答案详解
- 2025年福建省泉州信息工程学院招聘备考题库及一套参考答案详解
- 2025西北工业大学国际合作处招聘备考题库及答案详解参考
- 2024-2025学年广东省广州市越秀区八年级上学期期末数学试卷(含答案)
- 原材料进场验收制度规范
- (正式版)DB51∕T 3340-2025 《特长公路隧道消防站建设规范》
- 2026年中职财经商贸类专业教师资格证面试含答案
- 2026年太原城市职业技术学院单招综合素质笔试备考试题附答案详解
- 物业公司竞标方案
- 华东理工大学2026年公开招聘工作人员46名备考题库(含答案详解)
- 《急性主动脉综合征诊断与治疗规范中国专家共识(2021版)》重点
- 校园跑腿行业数据分析报告
- 2026年焊接安全员考试真题解析
- 检验科医患沟通培训课件

评论
0/150
提交评论