



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
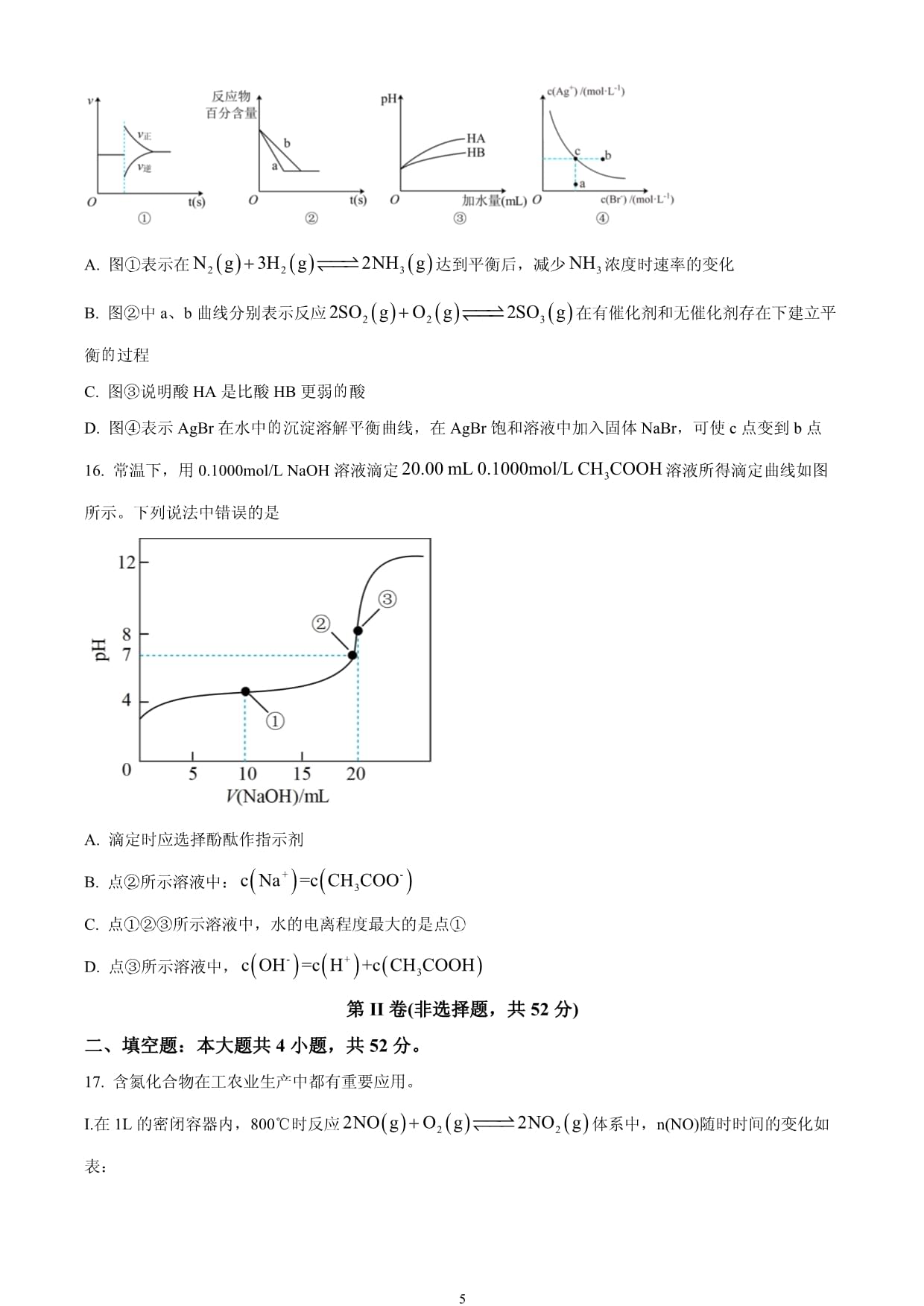
PAGEPAGE12022—2023学年度第一学期期末质量检测考试高二化学试题注意事项:1.试卷分为第I卷(选择题)和第II卷(非选择题)两部分,共100分,考试时间90分钟,共6页。2.答第I卷前考生务必在每小题选出〖答案〗后,用铅笔把答题卡上对应题目的〖答案〗标号涂黑,如需改动,用橡皮擦干净后,再选涂其他〖答案〗。3.第II卷答在答卷纸的相应位置上,否则视为无效。答题前考生务必将自己的班级、姓名、学号、考号座位号填写清楚。可能用到的相对原子质量:H-1C-12N-14O-16S-32Cl-35.5N-23Mg-24Al-27Fe-56Cu-64Zn-65Ag-108第I卷(选择题,共48分)一、单项选择题:本大题共16小题,每小题3分,共48分。在每小题列出的四个选项中,只有一项是最符合题目要求的,把〖答案〗填在答题卡上。1.今年9月24日,中科院的科研人员在线发表成果宣布创制了一条利用二氧化碳和电能人工合成淀粉的路线(ASAP路线):通过光伏发电电解水产生氢气,然后通过催化剂利用氢气和二氧化碳生成甲醇,使用多种优选的酶逐步将甲醇最后转化为淀粉。1立方米生物反应器年产淀粉量相当于5亩土地玉米种植的淀粉产量。下列说法错误的是A.ASAP路线体现了光能—电能—化学能的转变B.催化剂可以提高氢气和二氧化碳的平衡转化率C.酶在合成路线中使各步化学反应更容易发生D.ASAP路线生产在未来的发展具有广阔前景2.下列应用与盐类水解无主要关系的是A.保存溶液时,加入少量铁粉B.明矾可用作净水剂C.将饱和溶液滴入沸水中继续煮沸,制备氢氧化铁胶体D.草木灰(主要成分)与铵态氮肥不能混合施用3.下列不能用勒夏特列原理解释的是A.氨水中加酸,溶液中的浓度增大B.合成氨工业中不断从反应混合物中液化分离出氨气C.硫酸工业上将转化为为放热反应,故理论上低温条件有利于提高转化率D.由、、组成的平衡体系加压后颜色变深4.下列叙述正确的是A.由C(s,石墨)C(s,金刚石),可知金刚石比石墨更稳定B.,则中和热为C.,则氢气燃烧热为D.若,,则5.多相催化反应是在催化剂表面通过吸附、解吸过程进行的。如图,我国学者发现时,甲醇在铜基催化剂上的反应机理如图(该反应为可逆反应)。下列有关说法不正确的是A.反应I为B.反应II:中反应物总键能小于生成物总键能C.优良的催化剂降低了反应的活化能,并减小反应热,节约了能源D.反应在低温条件下能自发进行6.10mL浓度为1mol/L的盐酸和过量的锌反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是A.再加入10mL浓度为0.5mol/L的硫酸B.加入几滴CuCl2溶液C.加入几滴NaNO3溶液D.加入少量CH3COONa溶液7.一定条件下的密闭容器中:,下列叙述不正确的是A.通入适当过量的氧气,有利于提高的转化率B.使用催化剂能缩短该反应到达平衡的时间C.平衡后降低压强,混合气体平均摩尔质量增大D.平衡后升高温度,混合气体中NO含量降低8.下列有关电化学知识应用中,说法正确的是A.用电解法精炼粗铜时,粗铜作阴极B.在镀件上电镀铜时,可用镀件作阳极C.工业上冶炼金属铝,常采用电解熔融氯化铝的方法D.在海轮外壳连接锌块,是采用了牺牲阳极的阴极保护法9.下列有关实验操作的叙述正确的是A.测中和热实验中,两烧杯中填满碎泡沫塑料的主要作用是固定烧杯B.测定溶液pH时,用洁净的玻璃棒蘸取待测液点在湿润的pH试纸上,再与标准比色卡对照读数C.氧化还原滴定实验中,高锰酸钾溶液应盛装在酸式滴定管中D.用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,达滴定终点时仰视读数,则测定结果偏低10.已知温度T时水的离子积常数为Kw,该温度下,将浓度为amol/L的一元酸HA与bmol/L的一元碱BOH等体积混合,可判断溶液呈中性的依据是A.a=b B.混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)C.混合溶液中,c(H+)= D.混合溶液的pH=711.下列离子方程式与所述事实相符且书写正确的是A.铅蓄电池的正极反应:B.纯碱溶液能使酚酞试液变红:C.闪锌矿(ZnS)遇溶液生成铜蓝(CuS):D.用情性电解电解饱和氨化钠溶液:12.下列图示装置不能达到实验目的的是A.图1:验证温度对化学平衡的影响B.图2:测定锌与稀硫酸的反应速率C.图3:验证FeCl3溶液对H2O2分解有催化作用D.图4:研究浓度对反应速率的影响13.天然气报警器的核心是气体传感器,当空间内甲烷达到一定浓度时,传感器随之产生电信号并联动报警,工作原理如图所示,其中可以在固体电解质中移动。当报警器触发工作时,下列说法正确的是A.多孔电极a上发生还原反应B.在电解质中移向b电极,电子在外电路中移向a电极C.多孔电极b极的电极反应式为D.当标准状况下0.56L的甲烷在多孔电极a完全反应时,流入传感控制器电路的电子有0.2mol14.下列叙述错误的是A.向的溶液中加入少量固体,溶液的pH会减小B.在的,溶液中一定存在:C.把的溶液与的KOH溶液混合,所得溶液中一定存在:D.常温下,在的稀盐酸和的溶液等体积混合后,溶液显碱性15.有关下列图像的分析正确的是A.图①表示在达到平衡后,减少浓度时速率的变化B.图②中a、b曲线分别表示反应在有催化剂和无催化剂存在下建立平衡过程C.图③说明酸HA是比酸HB更弱酸D.图④表示AgBr在水中沉淀溶解平衡曲线,在AgBr饱和溶液中加入固体NaBr,可使c点变到b点16.常温下,用0.1000mol/LNaOH溶液滴定溶液所得滴定曲线如图所示。下列说法中错误的是A.滴定时应选择酚酞作指示剂B.点②所示溶液中:C.点①②③所示溶液中,水的电离程度最大的是点①D.点③所示溶液中,第II卷(非选择题,共52分)二、填空题:本大题共4小题,共52分。17.含氮化合物在工农业生产中都有重要应用。I.在1L的密闭容器内,800℃时反应体系中,n(NO)随时时间的变化如表:时间(s)0123450.0200.0100.0080.0070.0070.007(1)0~2s内该反应的平均速率_______,达平衡时NO的转化率为_______。(2)写出该反应的平衡常数表达式_______。已知:,则该反应是_______反应(填“吸热”“放热”)。(3)如图表示的变化的曲线是_______。(4)不能说明该反应已达到平衡状态的是_______。A. B.容器内压强保持不变C. D.容器内气体密度保持不变(5)为使该反应反应速率增大,且可以提高NO转化率的是_______。A.及时分离出 B.增大的浓度C.适当升高温度 D.选择高效催化剂Ⅱ.肼()可用做发射卫星的火箭燃料。已知:①②(6)写出气态肼和生成氮气和水蒸气的热化学方程式_______。18.物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,根据所学知识回答下列问题:(1)下列方法中,可以使溶液中值增大的措施是_______(填序号)。a.加水稀释b.加入少量固体c.加少量烧碱溶液(2)常温下,将的酸HA溶液某和的NaOH溶液等体积混合后,混合溶液的。由此可知,酸HA是酸_______(填“强”或“弱”),该混合溶液中_______mol/L(填数值)。若将等浓度的此酸HA溶液和NaOH溶液等体积混合,混合后溶液呈_______性,其原因可用离子方程式表示为_______。(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.;b.NaClO;c.。(已知25℃时电离常数:,,HClO;)①三种溶液pH最大的是_______(用序号表示)。②溶液a的pH大于8,则溶液中_______(填“>”、“<”或“=”)。(4)已知25℃时,,。该温度下,和共存的悬浊液中,_______。19.下图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程。部分阳离子支氢氧化物形式沉淀时溶液的pH见下表:沉淀物开始沉淀2.77.54.4完全沉淀3.79.76.7请回答:(1)溶液B中含有的金属阳离子有_______(填离子符号)。(2)下列物质中最适宜做氧化剂X的是_______(填字母)。a.NaClOb.c.(3)加入试剂①是为了调节pH,则试剂①可以选择_______(填化学式),要调整的pH范围是_______。(4)溶液E经过操作①可得到胆矾,操作①为_______、过滤、洗涤。(5)为测定制得的胆矾样品的纯度(样品中不含能与发生反应的氧化性杂质),某学习小组采用了“间接碘量法”,过程如下;取1.200g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(CuI)。用标准溶液滴定,到达滴定终点时,消耗标准溶液40.00mL。已知相关反应如下:,。①可选用_______作滴定指示剂,滴定终点的现象是:当滴入最后一滴标准液时,_______。②该试样中的质量分数为_______(保留一位小数)。20.某化学兴趣小组设计了如下图所示的电化学实验装置,其中c为石墨电极,d为银电极,按要求填空:(1)甲池中移向_______极(填电极的字母序号),f为_______(填电极名称)。(2)a极上的电极反应式是_______。(3)乙池中放出气体的电极为_______极(填“c”或“d”),写出此电极反应式_______。(4)乙池中总反应的离子方程式是_______。(5)当乙池中阴极质量增加5.40g时,丙池中某电极析出1.60g金属,则丙池溶液中溶质可能是_______(填序号)AB.C.NaClPAGEPAGE12022—2023学年度第一学期期末质量检测考试高二化学试题注意事项:1.试卷分为第I卷(选择题)和第II卷(非选择题)两部分,共100分,考试时间90分钟,共6页。2.答第I卷前考生务必在每小题选出〖答案〗后,用铅笔把答题卡上对应题目的〖答案〗标号涂黑,如需改动,用橡皮擦干净后,再选涂其他〖答案〗。3.第II卷答在答卷纸的相应位置上,否则视为无效。答题前考生务必将自己的班级、姓名、学号、考号座位号填写清楚。可能用到的相对原子质量:H-1C-12N-14O-16S-32Cl-35.5N-23Mg-24Al-27Fe-56Cu-64Zn-65Ag-108第I卷(选择题,共48分)一、单项选择题:本大题共16小题,每小题3分,共48分。在每小题列出的四个选项中,只有一项是最符合题目要求的,把〖答案〗填在答题卡上。1.今年9月24日,中科院的科研人员在线发表成果宣布创制了一条利用二氧化碳和电能人工合成淀粉的路线(ASAP路线):通过光伏发电电解水产生氢气,然后通过催化剂利用氢气和二氧化碳生成甲醇,使用多种优选的酶逐步将甲醇最后转化为淀粉。1立方米生物反应器年产淀粉量相当于5亩土地玉米种植的淀粉产量。下列说法错误的是A.ASAP路线体现了光能—电能—化学能的转变B.催化剂可以提高氢气和二氧化碳的平衡转化率C.酶在合成路线中使各步化学反应更容易发生D.ASAP路线生产在未来的发展具有广阔前景2.下列应用与盐类水解无主要关系的是A.保存溶液时,加入少量铁粉B.明矾可用作净水剂C.将饱和溶液滴入沸水中继续煮沸,制备氢氧化铁胶体D.草木灰(主要成分)与铵态氮肥不能混合施用3.下列不能用勒夏特列原理解释的是A.氨水中加酸,溶液中的浓度增大B.合成氨工业中不断从反应混合物中液化分离出氨气C.硫酸工业上将转化为为放热反应,故理论上低温条件有利于提高转化率D.由、、组成的平衡体系加压后颜色变深4.下列叙述正确的是A.由C(s,石墨)C(s,金刚石),可知金刚石比石墨更稳定B.,则中和热为C.,则氢气燃烧热为D.若,,则5.多相催化反应是在催化剂表面通过吸附、解吸过程进行的。如图,我国学者发现时,甲醇在铜基催化剂上的反应机理如图(该反应为可逆反应)。下列有关说法不正确的是A.反应I为B.反应II:中反应物总键能小于生成物总键能C.优良的催化剂降低了反应的活化能,并减小反应热,节约了能源D.反应在低温条件下能自发进行6.10mL浓度为1mol/L的盐酸和过量的锌反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是A.再加入10mL浓度为0.5mol/L的硫酸B.加入几滴CuCl2溶液C.加入几滴NaNO3溶液D.加入少量CH3COONa溶液7.一定条件下的密闭容器中:,下列叙述不正确的是A.通入适当过量的氧气,有利于提高的转化率B.使用催化剂能缩短该反应到达平衡的时间C.平衡后降低压强,混合气体平均摩尔质量增大D.平衡后升高温度,混合气体中NO含量降低8.下列有关电化学知识应用中,说法正确的是A.用电解法精炼粗铜时,粗铜作阴极B.在镀件上电镀铜时,可用镀件作阳极C.工业上冶炼金属铝,常采用电解熔融氯化铝的方法D.在海轮外壳连接锌块,是采用了牺牲阳极的阴极保护法9.下列有关实验操作的叙述正确的是A.测中和热实验中,两烧杯中填满碎泡沫塑料的主要作用是固定烧杯B.测定溶液pH时,用洁净的玻璃棒蘸取待测液点在湿润的pH试纸上,再与标准比色卡对照读数C.氧化还原滴定实验中,高锰酸钾溶液应盛装在酸式滴定管中D.用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,达滴定终点时仰视读数,则测定结果偏低10.已知温度T时水的离子积常数为Kw,该温度下,将浓度为amol/L的一元酸HA与bmol/L的一元碱BOH等体积混合,可判断溶液呈中性的依据是A.a=b B.混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)C.混合溶液中,c(H+)= D.混合溶液的pH=711.下列离子方程式与所述事实相符且书写正确的是A.铅蓄电池的正极反应:B.纯碱溶液能使酚酞试液变红:C.闪锌矿(ZnS)遇溶液生成铜蓝(CuS):D.用情性电解电解饱和氨化钠溶液:12.下列图示装置不能达到实验目的的是A.图1:验证温度对化学平衡的影响B.图2:测定锌与稀硫酸的反应速率C.图3:验证FeCl3溶液对H2O2分解有催化作用D.图4:研究浓度对反应速率的影响13.天然气报警器的核心是气体传感器,当空间内甲烷达到一定浓度时,传感器随之产生电信号并联动报警,工作原理如图所示,其中可以在固体电解质中移动。当报警器触发工作时,下列说法正确的是A.多孔电极a上发生还原反应B.在电解质中移向b电极,电子在外电路中移向a电极C.多孔电极b极的电极反应式为D.当标准状况下0.56L的甲烷在多孔电极a完全反应时,流入传感控制器电路的电子有0.2mol14.下列叙述错误的是A.向的溶液中加入少量固体,溶液的pH会减小B.在的,溶液中一定存在:C.把的溶液与的KOH溶液混合,所得溶液中一定存在:D.常温下,在的稀盐酸和的溶液等体积混合后,溶液显碱性15.有关下列图像的分析正确的是A.图①表示在达到平衡后,减少浓度时速率的变化B.图②中a、b曲线分别表示反应在有催化剂和无催化剂存在下建立平衡过程C.图③说明酸HA是比酸HB更弱酸D.图④表示AgBr在水中沉淀溶解平衡曲线,在AgBr饱和溶液中加入固体NaBr,可使c点变到b点16.常温下,用0.1000mol/LNaOH溶液滴定溶液所得滴定曲线如图所示。下列说法中错误的是A.滴定时应选择酚酞作指示剂B.点②所示溶液中:C.点①②③所示溶液中,水的电离程度最大的是点①D.点③所示溶液中,第II卷(非选择题,共52分)二、填空题:本大题共4小题,共52分。17.含氮化合物在工农业生产中都有重要应用。I.在1L的密闭容器内,800℃时反应体系中,n(NO)随时时间的变化如表:时间(s)0123450.0200.0100.0080.0070.0070.007(1)0~2s内该反应的平均速率_______,达平衡时NO的转化率为_______。(2)写出该反应的平衡常数表达式_______。已知:,则该反应是_______反应(填“吸热”“放热”)。(3)如图表示的变化的曲线是_______。(4)不能说明该反应已达到平衡状态的是_______。A. B.容器内压强保持不变C. D.容器内气体密度保持不变(5)为使该反应反应速率增大,且可以提高NO转化率的是_______。A.及时分离出 B.增大的浓度C.适当升高温度 D.选择高效催化剂Ⅱ.肼()可用做发射卫星的火箭燃料。已知:①②(6)写出气态肼和生成氮气和水蒸气的热化学方程式_______。18.物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,根据所学知识回答下列问题:(1)下列方法中,可以使溶液中值增大的措施是_______(填序号)。a.加水稀释b.加入少量固体c.加少量烧碱溶液(2)常温下,将的酸HA溶液某和的NaOH溶液等体积混合后,混合溶液的。由此可知,酸HA是酸_______(填“强”或“弱”),该混合溶液中_______mol/L(填数值)。若将等浓度的此酸HA溶液和NaOH溶液等体积混合,混合后溶液呈_______性,其原因可用离子方程式表示为_______。(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.;b.NaClO;c.。(已知25℃时电离常数:,,HClO;)①三种溶液pH最大的是_______(用序号表示)
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2025年文化遗产保护与管理考试题及答案
- spijava面试题及答案
- 公共政策与社会稳定的关系探讨试题及答案
- 城市犯罪防控政策的有效性评估试题及答案
- 软考网络工程师复习计划与试题及答案
- 新考纲适应策略2025年信息系统项目管理师试题及答案
- 西方政治制度对国际关系的影响试题及答案
- 公共政策中的风险管理策略试题及答案
- 公共政策实施中的风险管理试题及答案
- 如何提升信息系统项目管理师考试中的独立思考能力试题及答案
- 电场电场强度
- 白酒质量要求 第4部分:酱香型白酒
- JT-T-329-2010公路桥梁预应力钢绞线用锚具、夹具和连接器
- 湖北武汉市2024届高三冲刺模拟数学试卷含解析
- 2024年浙江台州椒江区公安局警务辅助人员招聘笔试参考题库附带答案详解
- 广东省广州市天河区2024年八年级下册数学期末考试试题含解析
- 土木工程专业毕业答辩常问问题
- 红色大气商务企业启动会企业启动仪式
- 2024年新改版苏教版六年级下册科学全册复习资料
- 手机制造行业未来五至十年行业分析
- 《发酵生物技术》课件

评论
0/150
提交评论