



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、酶的作用机制和酶的调节酶的作用机制和酶的调节酶的活性部位酶的活性部位 酶的结构及酶的结构及催化作用机制催化作用机制 a,a,结合部位结合部位 Binding siteBinding site 酶分子中与底物结合的部位或区域一般称为结合部位。酶分子中与底物结合的部位或区域一般称为结合部位。 酶分子的结构特点酶分子的结构特点n酶分子中促使底物发生酶分子中促使底物发生化学变化的部位称为催化学变化的部位称为催化部位化部位。n通常将酶的结合部位和通常将酶的结合部位和催化部位总称为酶的活催化部位总称为酶的活性部位或活性中心。性部位或活性中心。n结合部位决定酶的专一结合部位决定酶的专一性,性,n催化部位决定
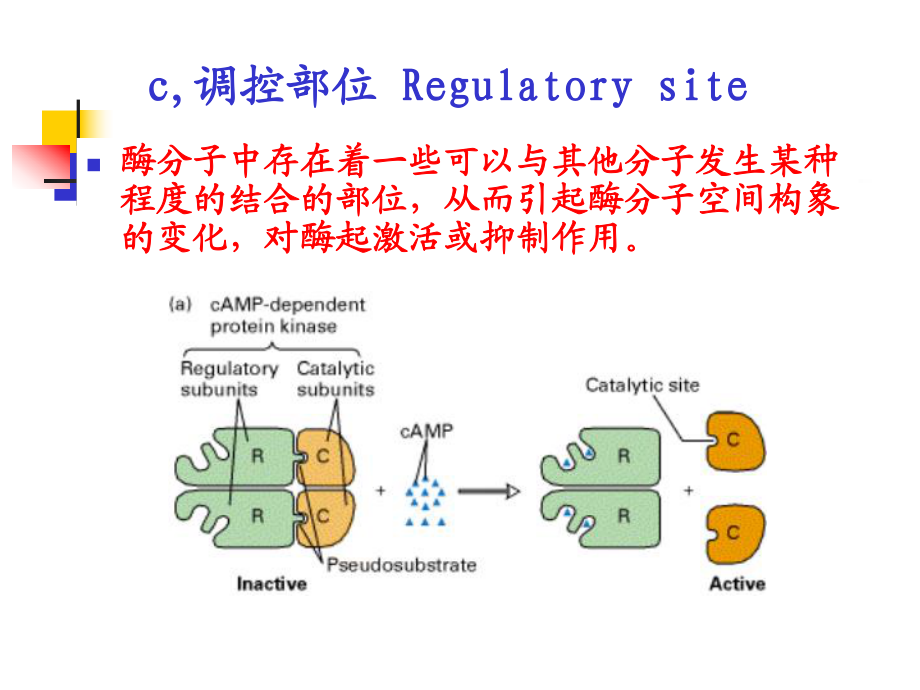
2、酶所催化催化部位决定酶所催化反应的性质。反应的性质。2 2催化部位催化部位 catalytic sitecatalytic siten酶分子中存在着一些可以与其他分子发生某种酶分子中存在着一些可以与其他分子发生某种程度的结合的部位,从而引起酶分子空间构象程度的结合的部位,从而引起酶分子空间构象的变化,对酶起激活或抑制作用。的变化,对酶起激活或抑制作用。c,c,调控部位调控部位 Regulatory siteRegulatory siten 酶分子上具有一定酶分子上具有一定空间构象的部位,该空间构象的部位,该部位化学基团集中,部位化学基团集中,直接参与将底物转变直接参与将底物转变为产物的反应过程
3、,为产物的反应过程,这一部位就称为这一部位就称为酶的酶的活性中心活性中心。 酶活性中心酶活性中心酶的活性中心酶的活性中心酶的活性中心酶的活性中心 结合基团结合基团 活性中心内必需基团活性中心内必需基团 催化基团催化基团 活性中心外必需基团活性中心外必需基团酶活性中心酶活性中心主要包括:主要包括:亲核性基团:丝氨酸亲核性基团:丝氨酸的羟基,半胱氨酸的羟基,半胱氨酸的巯基和组氨酸的的巯基和组氨酸的咪唑基。咪唑基。H2NCHCCH2OHOOHOHH2NCHCCH2OHOSHSHH2NCHCCH2OHONNHNNH酶活性中心的必需基团酶活性中心的必需基团酸碱性基团:酸碱性基团: 门冬氨酸门冬氨酸和谷氨
4、酸的羧和谷氨酸的羧基,赖氨酸的基,赖氨酸的氨基,酪氨酸氨基,酪氨酸的酚羟基,组的酚羟基,组氨酸的咪唑基氨酸的咪唑基和半胱氨酸的和半胱氨酸的巯基等。巯基等。H2NCHCCH2OHOCH2COHOH2NCHCCH2OHOCOHOCOOHH2NCHCCH2OHOCH2CH2CH2NH2NH2H2NCHCCH2OHOOHOH研究活性中心的主要方法研究活性中心的主要方法 1 1、化学修饰法(共价标记法)、化学修饰法(共价标记法) (1 1)DFPDFP或或DIFPDIFP(二异丙基氟磷酸)(二异丙基氟磷酸) (2 2)TPCKTPCK(N-N-对甲苯磺酰苯丙酰氯甲对甲苯磺酰苯丙酰氯甲 基酮)基酮) TP
5、CKTPCK修饰修饰HisHis,使,使HisHis烷基化烷基化 (3)碘乙酸、对氯 汞苯甲酸修饰巯基 1 1、动力学参数测、动力学参数测 定定: :如如pH;pK; pH;pK; 2 2、X-X-光衍射分析光衍射分析 3 3、基因定位突变法、基因定位突变法诱导契合学说(诱导契合学说(induced-fit theoryinduced-fit theory) 19581958年年 KoshlandKoshland提出提出酶的作用机理酶的作用机理n2.2 诱导契合机制诱导契合机制nA.靠近靠近定向定向电性吸引、疏水作用诱导契合诱导契合:互补性结构变化互补性结构变化能否契合能否契合专一性的由来专一
6、性的由来活性中心催化活性中心催化基团进行催化基团进行催化酶复原酶复原催化剂催化剂产物脱离产物脱离:A.A.羧肽酶羧肽酶A A未结合未结合底物时的构象变底物时的构象变化化B.B. 邻近效应:邻近效应:指两个反应的分子,它们反指两个反应的分子,它们反应的基团需要互相靠近,才能反应。应的基团需要互相靠近,才能反应。 定向效应定向效应: :指酶的催化基团与底物的反指酶的催化基团与底物的反应基团之间的正确向。应基团之间的正确向。 1.1.靠近作用靠近作用: :提高了提高了酶的活性中心酶的活性中心底物的浓度底物的浓度2.2.定向作用定向作用: :缩短了缩短了底物与催化基团间底物与催化基团间的距离的距离 提
7、高反应速度(成功率)提高反应速度(成功率)10108 8倍倍使酶具有使酶具有高高催化催化效率的有关因素效率的有关因素: :A. A. 底物和酶的邻近定向效应底物和酶的邻近定向效应: :n在酶促反应中,底物分子结合到酶的活性在酶促反应中,底物分子结合到酶的活性中心,一方面底物在酶活性中心的有效浓中心,一方面底物在酶活性中心的有效浓度大大增加,有利于提高反应速度;度大大增加,有利于提高反应速度;n另一方面,由于活性中心的立体结构和相另一方面,由于活性中心的立体结构和相关基团的诱导和定向作用,使底物分子中关基团的诱导和定向作用,使底物分子中参与反应的基团相互接近,并被严格定向参与反应的基团相互接近,
8、并被严格定向定位,使酶促反应具有高效率和专一性特定位,使酶促反应具有高效率和专一性特点。点。邻基效应和定向效应邻基效应和定向效应张力效应和底物形变张力效应和底物形变 底物结合可以诱底物结合可以诱导酶分子构象的变化导酶分子构象的变化, ,而变化的酶分子又使而变化的酶分子又使底物分子的敏感键产底物分子的敏感键产生生“张力张力”甚至甚至 “变形变形”, ,从而促进从而促进酶酶- -底物中间产物进底物中间产物进入过渡态入过渡态. .这实际上这实际上是酶与底物诱导契合是酶与底物诱导契合的动态过程的动态过程. . 张力学说张力学说 这是一个形成内酯的反应。当这是一个形成内酯的反应。当 R RCHCH3 3
9、时,其反应速度比时,其反应速度比 R RH H的情况快的情况快315315倍。倍。 由于由于-CH-CH3 3体积比较大,与反应基团之间体积比较大,与反应基团之间产生一种立体排斥张力,从而使反应基团产生一种立体排斥张力,从而使反应基团之间更容易形成稳定的五元环过渡状态。之间更容易形成稳定的五元环过渡状态。 RCRC H2O HOO HH2ORROOHHSreric strain 多功能催化作用多功能催化作用 酶的活性中心部位,一般都含有多酶的活性中心部位,一般都含有多个起催化作用的基团,这些基团在空间个起催化作用的基团,这些基团在空间有特殊的排列和取向,可以对底物价键有特殊的排列和取向,可以对
10、底物价键的形变和极化及调整底物基团的位置等的形变和极化及调整底物基团的位置等起到协同作用,从而使底物达到最佳反起到协同作用,从而使底物达到最佳反应状态应状态。NHOOOH.CH3OCH3OCH3OCH3OOHCH3OCH3OCH3OCH3OCOHNOH.酸碱催化酸碱催化 酶活性中心提供酶活性中心提供或提供或提供使使敏感键断裂的机制敏感键断裂的机制称酸碱催化称酸碱催化。 酸酸- -碱催化可分为狭义的酸碱催化可分为狭义的酸- -碱催化碱催化和广义的酸和广义的酸- -碱催化。酶参与的酸碱催化。酶参与的酸- -碱催碱催化反应一般都是广义的酸碱催化方式。化反应一般都是广义的酸碱催化方式。 广义酸碱催化是
11、指通过质子酸提广义酸碱催化是指通过质子酸提供部分质子供部分质子, ,或是通过质子碱接受部分或是通过质子碱接受部分质子的作用,达到降低反应活化能的过质子的作用,达到降低反应活化能的过程程。酶分子中可以作为广义酸、碱的基团酶分子中可以作为广义酸、碱的基团 广义酸基团广义酸基团 广义碱基团广义碱基团(质子供体)(质子供体) (质子受体)(质子受体) His His 是酶的酸碱催化作用中最活泼的一个催化功能团。是酶的酸碱催化作用中最活泼的一个催化功能团。酸催化酸催化(OH、NH3+、NH+、-COOH、SH)A- : H+EHE-EH + OH-+ H+AH + B+碱催化碱催化(失电子态失电子态)A
12、- : B+ E-COO- -A- + E-COOH E-COO- - + H+碱碱催化催化酸酸催化催化共价催化共价催化 共价催化又称亲共价催化又称亲核催化或亲电子催化核催化或亲电子催化 , ,在催化在催化时时, ,亲核性催化剂或亲亲核性催化剂或亲电子催化电子催化 剂能分别放剂能分别放出电子或出电子或汲取电子并作用于底汲取电子并作用于底物的去缺电子中心或物的去缺电子中心或负电中心负电中心, ,迅速形成不稳定的中迅速形成不稳定的中间复合物间复合物, ,降低反应活降低反应活化能使化能使 反应加速反应加速. . 共价催化共价催化 催化剂通过与底物形成反应活性很高的催化剂通过与底物形成反应活性很高的共
13、价过渡产物,使反应活化能降低,从而提共价过渡产物,使反应活化能降低,从而提高反应速度的过程,称为共价催化高反应速度的过程,称为共价催化。 酶中参与共价催化的基团主要包括酶中参与共价催化的基团主要包括 His His 的咪唑基,的咪唑基,Cys Cys 的硫基,的硫基,Asp Asp 的羧基,的羧基,Ser Ser 的羟基等。的羟基等。 某些辅酶,如焦磷酸硫胺素和磷酸吡哆某些辅酶,如焦磷酸硫胺素和磷酸吡哆醛等也可以参与共价催化作用。醛等也可以参与共价催化作用。 A- : B+酶活性中心酶活性中心参与底物敏感参与底物敏感键断裂的机制称键断裂的机制称共价催化共价催化;亲电基团亲电基团 MgMg2+2
14、+、 MnMn2+ 2+ (有空轨道)(有空轨道)亲核基团亲核基团 + + -OH (有孤对电子有孤对电子)亲电催化亲电催化2A- : B+ + Mg2+A: MgA + + 2B+亲核催化亲核催化-OH-SHA- + + HO :B OHOH的亲核催化的亲核催化( (胰蛋白酶胰蛋白酶) )金属离子催化作用金属离子催化作用 1.1.提高水的亲核性能提高水的亲核性能 金属离子可以和水分子的金属离子可以和水分子的OH-OH-结合,使结合,使水显示出更大的亲核催化性能。水显示出更大的亲核催化性能。 2.2.电荷屏蔽作用电荷屏蔽作用电荷屏蔽作用是酶中金属离子的一个重要功能。电荷屏蔽作用是酶中金属离子的
15、一个重要功能。 多种激酶多种激酶( (如磷酸转移酶如磷酸转移酶) )的底物是的底物是Mg2+Mg2+ATPATP复复合物。合物。AHHO HHO HHO-OPOPOPOC H2OOOOOOM g2+电子传递中间体电子传递中间体 许多氧许多氧化化- -还原酶中都还原酶中都含有铜或铁离含有铜或铁离子,它们作为子,它们作为酶的辅助因子酶的辅助因子起着传递电子起着传递电子的功能的功能。 C=O靠近羧肽酶催化中的电子云形变羧肽酶催化中的电子云形变 定向极性专一性契合区H2+ +NC精氨酸精氨酸C C端确认区端确认区注意酶催化反应机制的酶催化反应机制的实例实例 溶菌酶(溶菌酶(LysozymeLysozy
16、me)核糖核酸酶与底物结合的三维空间结构核糖核酸酶与底物结合的三维空间结构3 3、羧肽酶、羧肽酶A A(carboxypeptidase Acarboxypeptidase A,CpACpA) 羧羧肽肽酶酶A酶单独存在时酶单独存在时酶底物复合物酶底物复合物胰凝乳蛋白酶胰凝乳蛋白酶酶和底物结合口袋酶酶 的的 调调 节节n 生物体内的各种生理活动均以一定的物质代谢为基础。生物体内的各种生理活动均以一定的物质代谢为基础。为了适应某种生理活动的变化,需要对一定的代谢活动进为了适应某种生理活动的变化,需要对一定的代谢活动进行调节。行调节。 n通过对酶的催化活性的调节,就可以达到调节代谢活动的通过对酶的催
17、化活性的调节,就可以达到调节代谢活动的目的。目的。 n可以通过改变其催化活性而使整个代谢反应的速度或方向可以通过改变其催化活性而使整个代谢反应的速度或方向发生改变的酶就称发生改变的酶就称为限速酶或关键酶为限速酶或关键酶。 酶结构的调节酶结构的调节酶结构的调节是通过对现有酶分子酶结构的调节是通过对现有酶分子的的结构影响来改变酶结构影响来改变酶的催化活性的调节方式。的催化活性的调节方式。酶结构的调节是一种快速调节方式。酶结构的调节是一种快速调节方式。酶活性的调节控制酶活性的调节控制变构调节(别构调节)变构调节(别构调节) n 某些代谢物能与变构酶分子上的变构某些代谢物能与变构酶分子上的变构部位特异
18、性结合,使酶的分子构象发生部位特异性结合,使酶的分子构象发生改变,从而改变酶的催化活性以及代谢改变,从而改变酶的催化活性以及代谢反应反应的速度,这种调节作用就称为的速度,这种调节作用就称为变构变构调节调节(allosteric regulation)。n 具有变构调节作用的酶就称为具有变构调节作用的酶就称为变构酶变构酶。n 凡能使酶分子变构并使酶的催化活性发凡能使酶分子变构并使酶的催化活性发生改变的代谢物就称为生改变的代谢物就称为变构剂变构剂。 n大肠杆菌天冬氨酸转氨甲酰酶大肠杆菌天冬氨酸转氨甲酰酶(ATCase)(ATCase)的半分子的半分子(C3R3C3R3)的三维结构:)的三维结构:1
19、 1、活性中心在催化亚基上;、活性中心在催化亚基上;2 2、别构中心在调节亚基上;、别构中心在调节亚基上;(1)ATCase催化的化学反应和ATCase的动力学曲线 ATCaseATCase的别构效应的别构效应a变构调节的机制:变构调节的机制:n变构酶一般是多亚基构成的聚合体,一些亚基为催化亚基,变构酶一般是多亚基构成的聚合体,一些亚基为催化亚基,另一些亚基为调节亚基。另一些亚基为调节亚基。n当调节亚基或调节部位与变构剂结合后,就可导致酶的空当调节亚基或调节部位与变构剂结合后,就可导致酶的空间构象发生改变,从而导致酶的催化活性中心的构象发生间构象发生改变,从而导致酶的催化活性中心的构象发生改变
20、而致酶活性的改变。改变而致酶活性的改变。 (ATCase)变构酶聚合体变构酶聚合体催化亚基催化亚基三聚体三聚体调节亚基调节亚基二聚体二聚体别构酶调节酶活性的机理别构酶调节酶活性的机理 1 1、对称或协同模型(、对称或协同模型(symmetry or concerted symmetry or concerted model,model,也称齐变模型、也称齐变模型、MWCMWC模型)模型); 1965; 1965年由年由MonodMonod、WymanWyman和和ChangeuxChangeux提出。该模型的要点提出。该模型的要点 : : 2 2、序变模型(、序变模型(sequential m
21、odelsequential model,也称,也称KNFKNF模型)模型)19661966年由年由KoshlandKoshland、NemethyNemethy和和FilmerFilmer提出。提出。该模型的要点该模型的要点 : : b协同效应:协同效应:n当变构酶的一个亚基与其配体(底物或变构剂)当变构酶的一个亚基与其配体(底物或变构剂)结合后,能够通过改变相邻亚基的构象而使其对结合后,能够通过改变相邻亚基的构象而使其对配体的亲和力发生改变,这种效应就称为变构酶配体的亲和力发生改变,这种效应就称为变构酶的的协同效应协同效应。n如果对相邻亚基的影响是导致其对配体的亲和力如果对相邻亚基的影响是
22、导致其对配体的亲和力增加,则称为增加,则称为正协同效应正协同效应;反之,则称为;反之,则称为负协同负协同效应效应。n如果是同种配体所产生的影响,则称为如果是同种配体所产生的影响,则称为同促协同同促协同效应效应。如果是不同配体之间产生的影响则。如果是不同配体之间产生的影响则称为异称为异促协同效应。促协同效应。 n 观察变构酶的底物浓度对酶促反应速度影响观察变构酶的底物浓度对酶促反应速度影响时,可发现时,可发现SS为一为一“S S”形曲线形曲线。这是由。这是由于底物对变构酶存在于底物对变构酶存在同促正协同效应同促正协同效应。 n当存在当存在异促正协同效应异促正协同效应时,时,“S S”形曲线形曲线
23、左移左移,酶促,酶促反应速度加快;当存在反应速度加快;当存在异促负协同效应异促负协同效应时,时,“S S”形形曲线曲线右移右移,酶促反应速度减慢。,酶促反应速度减慢。 别构酶的作用动力学别构酶的作用动力学 1 1、正协同效应(、正协同效应(positive cooperative effectpositive cooperative effect)2 2、负协同效应(、负协同效应(negative cooperative effectnegative cooperative effect) c. 变构调节的方式变构调节的方式:n变构酶通常为代谢途径的起始关键酶,而变构剂则变构酶通常为代谢途径的
24、起始关键酶,而变构剂则为代谢途径的终产物。因此,变构剂一般以为代谢途径的终产物。因此,变构剂一般以反馈反馈方方式对代谢途径的起始关键酶进行调节,最常见的为式对代谢途径的起始关键酶进行调节,最常见的为负反馈负反馈调节。调节。 酶活性的改变通过酶酶活性的改变通过酶分子构象分子构象的改变而实现;的改变而实现; 酶的变构仅涉及酶的变构仅涉及非共价键非共价键的变化;的变化; 调节酶活性的因素为调节酶活性的因素为代谢物代谢物; 为一为一非耗能非耗能过程;过程; 无放大无放大效应。效应。 d变构调节的特点:变构调节的特点: 酶原的激活酶原的激活 n 处于无活性状态的酶的前身物质就称为处于无活性状态的酶的前身
25、物质就称为酶原酶原。n 酶原在一定条件下转化为有活性的酶的酶原在一定条件下转化为有活性的酶的过程称为过程称为酶原的激活酶原的激活。n 酶原的激活过程通常伴有酶蛋白一级结酶原的激活过程通常伴有酶蛋白一级结构的改变构的改变。 胰蛋白酶胰蛋白酶/ /肠激酶肠激酶胰蛋白酶原胰蛋白酶原 胰蛋白酶胰蛋白酶 + N+ N端端6 6肽片段肽片段 n 酶原激活的机制为:酶原分子一级结构的酶原激活的机制为:酶原分子一级结构的改变导致了酶原分子空间结构的改变,使改变导致了酶原分子空间结构的改变,使催催化活性中心化活性中心得以形成,故使其从无活性的酶得以形成,故使其从无活性的酶原形式转变为有活性的酶。原形式转变为有活
26、性的酶。n 酶原激活的生理意义在于:酶原激活的生理意义在于:保护自身组织保护自身组织细胞细胞不被酶水解消化。不被酶水解消化。 2 2、胰蛋白酶原(、胰蛋白酶原(trypsinogentrypsinogen)的激活)的激活 HCl胃胃蛋蛋白白酶酶原原pH1.52(从从N N端端失失去去4 44 4个个氨氨基基酸酸残残基基)自自身身激激活活胃胃蛋蛋白白酶酶1 1、胃蛋白酶原(、胃蛋白酶原(pepsinogenpepsinogen)的激)的激活活3 3、胰凝乳蛋白酶原(、胰凝乳蛋白酶原(chymotrypsinogenchymotrypsinogen)的激活)的激活 共价修饰调节共价修饰调节 1.1
27、.酶蛋白分子中的某些基团可以在其他酶的催化酶蛋白分子中的某些基团可以在其他酶的催化下发生共价修饰,从而导致酶活性的改变,称下发生共价修饰,从而导致酶活性的改变,称为为共价修饰调节共价修饰调节。2.2.共价修饰调节也是体内共价修饰调节也是体内快速快速调节代谢活动的一调节代谢活动的一种重要的方式。种重要的方式。3.3.最常见的共价修饰方式有:最常见的共价修饰方式有:磷酸化磷酸化- -脱磷酸化脱磷酸化,-SH - -S-S-SH - -S-S-,乙酰化,乙酰化- -脱乙酰化,腺苷化脱乙酰化,腺苷化- -脱脱腺苷化等。腺苷化等。4.4.常见的常见的共价调节酶共价调节酶是磷酸化是磷酸化/ /脱磷酸化,腺
28、苷脱磷酸化,腺苷酰化酰化/ /脱腺苷酰化,乙酰化脱腺苷酰化,乙酰化/ /脱乙酰化,尿苷酰脱乙酰化,尿苷酰化化/ /脱尿苷酰化,甲基化脱尿苷酰化,甲基化/ /脱甲基化,脱甲基化,S-S/SHS-S/SH相相互转变,共互转变,共6 6种类型。种类型。 共价修饰调节的特点:共价修饰调节的特点: 酶以两种不同修饰和不同活酶以两种不同修饰和不同活性的形式存在;性的形式存在; 有共价键的变化;有共价键的变化; 受其他调节因素(如激素)受其他调节因素(如激素)的影响;的影响; 一般为耗能过程;一般为耗能过程; 存在放大效应。存在放大效应。 酶分子中存在着一些可以与其他分子发生某种程度的结合的部位,酶分子中存
29、在着一些可以与其他分子发生某种程度的结合的部位,从而引起酶分子空间构象的变化,对酶起激活或抑制作用。从而引起酶分子空间构象的变化,对酶起激活或抑制作用。 酶含量的调节酶含量的调节n 酶含量的调节是指通过改变细胞中酶蛋白合成酶含量的调节是指通过改变细胞中酶蛋白合成或降解的速度来调节酶分子的绝对含量,影响或降解的速度来调节酶分子的绝对含量,影响其催化活性,从而调节代谢反应的速度。其催化活性,从而调节代谢反应的速度。n 酶含量的调节是机体内酶含量的调节是机体内迟缓调节迟缓调节的重要方式。的重要方式。 糖原糖原 G-1-P + G-1-P + 糖原糖原+ H3PO4糖原磷酸化酶糖原磷酸化酶(n-1n-
30、1个个GlcGlc基)基) (n n个个GlcGlc基)基) 共价调节酶最典型的例子是共价调节酶最典型的例子是 动物组织的糖原磷酸化酶动物组织的糖原磷酸化酶1. 1. 糖原磷酸化酶催化的反应糖原磷酸化酶催化的反应 催化糖原的磷酸解,生成催化糖原的磷酸解,生成G-1-PG-1-P。 酶蛋白合成的调节酶蛋白合成的调节 n酶蛋白的合成速度通常通过一些诱导剂或阻遏剂来酶蛋白的合成速度通常通过一些诱导剂或阻遏剂来进行调节。凡能促使基因转录增强,从而使酶蛋白进行调节。凡能促使基因转录增强,从而使酶蛋白合成增加的物质就称为合成增加的物质就称为诱导剂诱导剂;反之,则称为;反之,则称为阻遏阻遏剂。剂。n酶的底物
31、对酶蛋白的合成具有诱导作用;代谢终产酶的底物对酶蛋白的合成具有诱导作用;代谢终产物对酶的合成有阻遏作用物对酶的合成有阻遏作用 。n激素可以诱导关键酶的合成,也可阻遏关键酶的合激素可以诱导关键酶的合成,也可阻遏关键酶的合成成 。酶蛋白降解的调节酶蛋白降解的调节通过调节酶的降解速度以控制酶的活性。通过调节酶的降解速度以控制酶的活性。 同工酶的调节同工酶的调节 在同一种属中,催化活性相同而酶蛋白的在同一种属中,催化活性相同而酶蛋白的分子结构,理化性质及免疫学性质不同的一组分子结构,理化性质及免疫学性质不同的一组酶称为酶称为同工酶同工酶(isoenzyme)(isoenzyme)。 同工酶在体内的生理
32、意义主要在于适应不同工酶在体内的生理意义主要在于适应不同组织或不同细胞器在代谢上的不同需要。同组织或不同细胞器在代谢上的不同需要。 心肌中以心肌中以LDHLDH1 1含量最多含量最多,LDHLDH1 1对乳酸的对乳酸的亲和力较高,因此它的主要作用是催化乳酸转亲和力较高,因此它的主要作用是催化乳酸转变为丙酮酸再进一步氧化分解,以供应心肌的变为丙酮酸再进一步氧化分解,以供应心肌的能量。能量。 在在骨骼肌中含量最多的是骨骼肌中含量最多的是LDHLDH5 5,LDHLDH5 5对对丙酮酸的亲和力较高,因此它的主要作用是催丙酮酸的亲和力较高,因此它的主要作用是催化丙酮酸转变为乳酸,以促进糖酵解的进行。化
33、丙酮酸转变为乳酸,以促进糖酵解的进行。 乳酸脱氢酶同工酶(乳酸脱氢酶同工酶(LDHsLDHs) 为四聚体,在体内共有五种分子形式为四聚体,在体内共有五种分子形式: : 即即LDHLDH1 1(H H4 4),),LDHLDH2 2(H H3 3M M),),LDHLDH3 3(H H2 2M M2 2),),LDHLDH4 4(HMHM3 3)和)和LDHLDH5 5(M M4 4)。)。 2 2、功能、功能 催化的反应催化的反应 乳酸乳酸 丙酮酸丙酮酸 LDH5骨骼肌骨骼肌: :乳酸乳酸 丙酮酸丙酮酸 心肌心肌: :LDH1 总结总结酶是生物催化剂。生物体内的各种化学变化都酶是生物催化剂。生
34、物体内的各种化学变化都在酶的催化下进行。在酶的催化下进行。特点:催化效率高,具高度专一性,作用条件特点:催化效率高,具高度专一性,作用条件温和,但很不稳定。温和,但很不稳定。酶是蛋白质,比其他催化剂脆弱。酶是蛋白质,比其他催化剂脆弱。酶蛋白的构象的不同决定了各种酶只有不同的酶蛋白的构象的不同决定了各种酶只有不同的底物专一性。底物专一性。动力学研究表明:动力学研究表明:酶反映中存在有酶反映中存在有 ES ES 中间物中间物, , 催化作用的本质催化作用的本质是酶,通过专一性结合的相互作用,而对于与是酶,通过专一性结合的相互作用,而对于与受作用的底物所形成的过液态分子予以稳定,受作用的底物所形成的
35、过液态分子予以稳定,从而起到加速反应的作用。从而起到加速反应的作用。米氏方程,米氏学术论米氏方程,米氏学术论给出了给出了 KmKm、SS及及VmaxVmax间的数字关系间的数字关系一般测定酶活力选用如下的条件:一般测定酶活力选用如下的条件:在最适在最适 PHPH、最适温度、底物极大地过量(即、最适温度、底物极大地过量(即SESE)的条件下)的条件下, ,测定酶反应的初速度。测定酶反应的初速度。 n一个酶的活力单位定义:一个酶的活力单位定义:25下,每分钟转变下,每分钟转变1ug分子分子底物的酶量。底物的酶量。n比活力定义:比活力定义:每每mg 酶蛋白所具有的酶活力单位数。酶蛋白所具有的酶活力单
36、位数。n酶的可逆抑制中最重要的是酶的可逆抑制中最重要的是: 竞争性抑制,可以通过竞争性抑制,可以通过加大底物浓度而得到逆转。加大底物浓度而得到逆转。n竞争性抑制剂的结构竞争性抑制剂的结构与底物十分类似,与底物争夺酶与底物十分类似,与底物争夺酶的活性中心。的活性中心。n非竞争性抑制剂非竞争性抑制剂_抑制剂与酶分子活性中心之外的抑制剂与酶分子活性中心之外的重要基团(重要基团(-SH)作用而造成的抑制。)作用而造成的抑制。n不可逆抑制剂不可逆抑制剂_使酶分子中一些重要基团发生特大使酶分子中一些重要基团发生特大的、不可逆的变化。的、不可逆的变化。 酶反应速度极高的原因酶反应速度极高的原因5 5个方面,
37、其中最主要的是:个方面,其中最主要的是:a. a. 酶与底物结合时,两者构象的改变使它们相互契合。酶与底物结合时,两者构象的改变使它们相互契合。b. b. 底物分子适当地向酶分子活性中心靠近。底物分子适当地向酶分子活性中心靠近。 c. c. 底物趋向于酶的催化部位。底物趋向于酶的催化部位。d. d. 活性中心这一局部地区的底物浓度大大增高。活性中心这一局部地区的底物浓度大大增高。e. e. 底物分子发生扭曲,易于断裂。底物分子发生扭曲,易于断裂。 使酶反应速度增高的其它因素:使酶反应速度增高的其它因素:a a 酶与底物形成有一定稳定度的过度态中间物酶与底物形成有一定稳定度的过度态中间物 _共价的共价的ES ES 中间物中间物迅速分解成产物迅速分解成产物b b 酶活性中
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 怎样留住酒店员工
- 2026年中国鼻渊丸行业市场占有率及投资前景预测分析报告
- 2026年中国泵车行业市场调查研究报告
- 四肢骨科手术麻醉管理
- 2026年莱州岸线岸滩整治修复工程海洋环境影响评价报告书山东海洋与渔业厅
- 2026年工业分析专业专科实习报告
- 好兔子舞蹈课件
- 2026年中国电机振动台行业市场规模及未来投资方向研究报告
- 公司员工绩效考核指标设置方法
- 电子元器件检测与分析技术指南
- 2025年军队文职人员招聘考试题库附答案(满分必刷)
- 2025赤峰翁牛特旗公立医院招聘29名员额备案制工作人员考试笔试备考试题及答案解析
- 2025高中政治主观题答题模板
- 2025贵州天健福康医养供应链有限责任公司招聘劳动合同制人员18人实施考试参考试题及答案解析
- 2025下半年厦门市总工会招聘工会专干和集体协商指导员50人考试参考题库及答案解析
- 2025年中小学教师职称评定答辩题(附答案)
- 自制小水车课件
- 工会集体协商课件
- 国开2025年《行政领导学》形考作业1-4答案
- 【MOOC答案】《中国文化传承与科技创新》(北京邮电大学)中国慕课章节作业网课答案
- NB-T 10560-2021 风力发电机组技术监督规程

评论
0/150
提交评论