



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
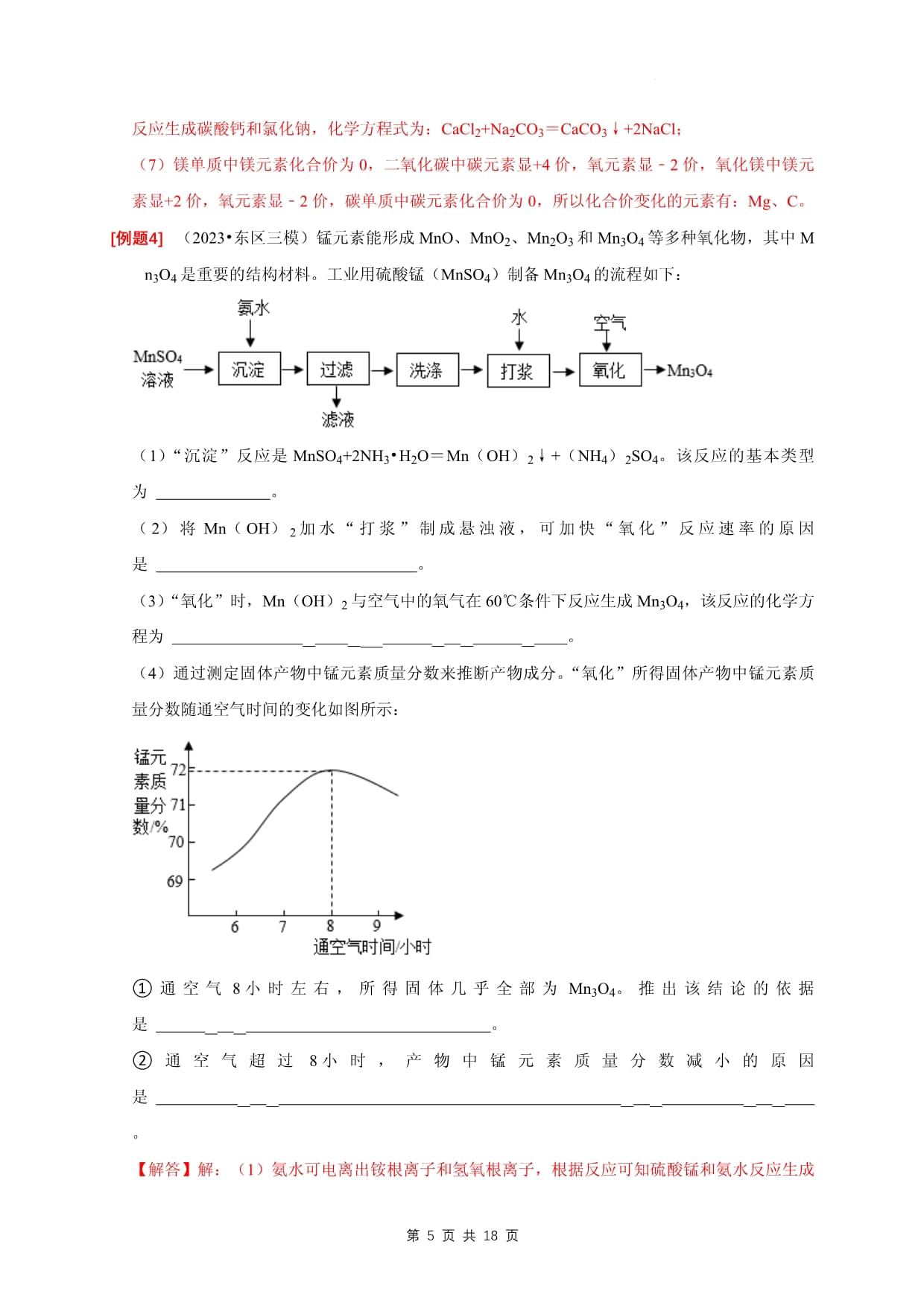
第页专题10工艺流程题【题型一】原料预处理的方法及目的(2023秋•桂平市期末)某工厂产生的烧渣(主要含FeO、Fe2O3,还有一定量的SiO2)可用于制备绿矾(FeSO4•xH2O),工艺流程如图所示:资料1:SiO2不溶于水,也不与稀硫酸反应;资料2:+2价的铁元素容易被空气中的氧气氧化。(1)在“浸取”前,将烧渣粉碎,目的是。(2)“浸取”、“过滤”步骤后,滤液中的溶质有。(3)二氧化硫与硫酸铁溶液反应生成硫酸亚铁和硫酸,反应的化学方程式为:。(4)FeSO4溶液经过蒸发浓缩、、过滤、洗涤、低温干燥后得到FeSO4•xH2O晶体。(5)以上结晶过程最好在氮气环境中进行,氮气的作用是。【解答】解:(1)在“浸取”前,将烧渣粉碎,目的是增大反应物接触面积,使反应更快、更充分。故答案为:增大反应物接触面积,使反应更快、更充分。(2)稀硫酸和氧化亚铁反应生成硫酸亚铁和水,和氧化铁反应生成硫酸铁和水,“浸取”、“过滤”步骤后,滤液中的溶质有硫酸亚铁、硫酸铁、硫酸。故答案为:硫酸亚铁、硫酸铁、硫酸。(3)二氧化硫与硫酸铁溶液反应生成硫酸亚铁和硫酸,反应的化学方程式为SO2+2H2O+Fe2(SO4)3=2FeSO4+2H2SO4。(2023•榆树市模拟)“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来并加以利用。下图是利用氢氧化钠溶液“捕捉”CO2流程图(部分条件及物质未标出)。请根据有关信息回答问题:(1)氢氧化钠溶液喷成雾状的目的是。(2)在实验室实现操作a的分离方法是。(3)上述流程中没有涉及的基本反应类型是。(4)上述流程中,可以循环利用的主要物质有水、CaO、(填写化学式)。(5)若将5.6tCaO投入沉淀池,理论上最多可制得沉淀的质量为吨。【解答】解:(1)反应物接触面积越大反应越剧烈,氢氧化钠溶液喷成雾状的目的是增大接触面积,提高CO2的吸收率;(2)把不溶于液体的固体和液体分开属于过滤;用到的仪器有:烧杯、玻璃棒、漏斗,过滤时,玻璃棒的作用是引流;(3)氢氧化钙与碳酸钠反应属于复分解反应,碳酸钙高温生成氧化钙和二氧化碳,属于分解反应,氧化钙与水反应生成氢氧化钙属于化合反应,所以没有涉及到置换反应;(4)在前边的反应中属于反应物,到了后面的反应中成了生成物,这样的物质可循环使用,所以循环使用的物质有水、CaO、NaOH;(5)根据质量守恒定律,反应前后元素的质量不变,若将5.6tCaO投入沉淀池,理论上最多可制得沉淀的质量为5.6t×(40对原料进行预处理的常用方法及其目的:(1)粉碎(或研磨):增大反应物间的接触面积,加快反应速率,使反应更充分。(2)搅拌:使反应物充分接触,加快反应(或溶解)速率。(3)水浸:通过加水,使可溶物溶解,与不溶物分离。(4)酸(或碱)浸:使与酸或碱反应的物质溶解,与不溶物分离。(5)灼烧(或煅烧、焙烧):使固体或杂质在高温条件下分解,使反应充分进行或增大转化率。【题型二】核心化学反应与条件控制(2023•青羊区校级三模)Ⅰ、新能源汽车的动力来源是锂离子电池,如图是实验室从钴酸锂废极片【主要成分为钴酸锂(LiCoO2)】中回收得到Co2O3和Li2CO3的一种流程。(1)废极片粉末加入稀硫酸和过氧化氢进行酸浸的过程中,温度通常要控制在40℃以下,原因是。(2)操作3中检验沉淀洗涤干净的操作是。(3)操作4中,在高温条件下,CoC2O4在空气中反应生成Co2O3和二氧化碳,化学方程式为。(4)操作5中,Li2CO3晶体用热水洗涤比用冷水洗涤损耗更少,说明它的溶解度随温度的变化趋势与我们学过的(填名称)相似。Ⅱ、如图所示,坐标系的四个象限分别代表不同的反应类型,“→”表示物质间的一步转化关系,A、B、C、D分别是碳、碳酸钙、碳酸钠和碳酸中的一种。请回答:(5)B的化学式是。(6)D的用途是,写出转化①的化学方程式:。(7)转化②可通过2Mg+CO2点燃¯2MgO+C实现,其中化合价变化的元素有【解答】解:(1)过氧化氢不稳定,受热易分解,故温度通常要控制在40℃以下,原因是:防止过氧化氢受热分解;(2)操作3中沉淀如果没有洗涤干净,沉淀表面会附着硫酸根离子,钡离子能与硫酸根离子结合生成硫酸钡,故检验沉淀洗涤干净的操作是:取最后一次洗涤液于试管中,加入氯化钡溶液,无白色沉淀生成,说明洗涤干净;(3)操作4中,在高温条件下,CoC2O4在空气中反应生成Co2O3和二氧化碳,在空气中焙烧,氧气应参与了反应,化学方程式为:4CoC2O4+3O2高温¯2Co2O3+8CO2(4)操作5中,Li2CO3晶体用热水洗涤比用冷水洗涤损耗更少,说明它的溶解度随温度的升高而减小;氢氧化钙的溶解度随温度的升高而减小,故与氢氧化钙相似;(5)A、B、C、D分别是碳、碳酸钙、碳酸钠和碳酸中的一种,B通过分解反应生成二氧化碳,二氧化碳通过化合反应生成B,可推出B为碳酸,A通过化合反应转化为二氧化碳,二氧化碳通过置换反应转化为A,且结合(7)可知,镁和二氧化碳在点燃的条件下反应生成氧化镁和碳,该反应属于置换反应,可推出A为碳,C、D均能通过复分解反应转化为二氧化碳,D能转化为C,可推出C为碳酸钙,D为碳酸钠,代入验证,符合题意,所以B为碳酸,化学式为:H2CO3;(6)由分析可知,D为碳酸钠,碳酸钠可用于生产玻璃、洗涤剂等;转化①为碳酸钠和氯化钙反应生成碳酸钙和氯化钠,化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl;(7)镁单质中镁元素化合价为0,二氧化碳中碳元素显+4价,氧元素显﹣2价,氧化镁中镁元素显+2价,氧元素显﹣2价,碳单质中碳元素化合价为0,所以化合价变化的元素有:Mg、C。(2023•东区三模)锰元素能形成MnO、MnO2、Mn2O3和Mn3O4等多种氧化物,其中Mn3O4是重要的结构材料。工业用硫酸锰(MnSO4)制备Mn3O4的流程如下:(1)“沉淀”反应是MnSO4+2NH3•H2O=Mn(OH)2↓+(NH4)2SO4。该反应的基本类型为。(2)将Mn(OH)2加水“打浆”制成悬浊液,可加快“氧化”反应速率的原因是。(3)“氧化”时,Mn(OH)2与空气中的氧气在60℃条件下反应生成Mn3O4,该反应的化学方程为。(4)通过测定固体产物中锰元素质量分数来推断产物成分。“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示:①通空气8小时左右,所得固体几乎全部为Mn3O4。推出该结论的依据是。②通空气超过8小时,产物中锰元素质量分数减小的原因是。【解答】解:(1)氨水可电离出铵根离子和氢氧根离子,根据反应可知硫酸锰和氨水反应生成氢氧化锰和硫酸铵,属于两种化合物互相交换成分生成另外两种化合物的反应即复分解反应;(2)将氢氧化锰加水“打浆”制成悬浊液,可以在通入空气是与氧气充分接触从而加快“氧化”反应速率;(3)氢氧化锰与空气中的氧气在60℃条件下反应生成四氧化三锰和水,该反应的化学方程式为6Mn(OH)2+O260℃¯2Mn3O4+6H2(4)①硫酸锰中锰元素的质量分数=55×355×3+16×4×100%=72%,如图通空气8小时左右,所得固体中锰元素质量分数也是72%,故说明此时所得固体几乎全部为Mn3②通空气超过8小时,产物中锰元素质量分数减小的原因是部分Mn3O4转化为更高价态的锰的氧化物(或部分Mn3O4转化为Mn2O3、MnO2)。1.流程中反应条件的控制:(1)调节pH:使反应发生或者避免某反应的发生。(2)控制温度:①水浴加热-一受热均匀,便于控制温度。②温度太高:反应速率太快;物质可能分解、挥发等。③温度太低。反应速率可能太慢;物质转化率、产率不高等。(3)加入过量试剂:①完全除去某物质(非目标产物);②使某物质完全转化为目标产物。(4)通入保护气(如氨气):防止主物质与氧气等发生反应。2.化学方程式的书写:根据流程图书写某一步中发生反应的化学方程式:根据所学知识判断其可能发生的反应,然后写出反应物、产物,并进行配平。(2)陌生化学方程式的书写:根据箭头方向,箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物);若从已知信息中找出的反应物和生成物不满足质量守恒定律,可以在反应物或生成物中加上水,然后进行配平,还应注意反应条件的有关信息;若在空气中煅烧或通入空气则还需考虑空气中的氧气是否参与反应。【题型三】产品的分离提纯(2023•江西模拟)某工厂利用硼砂(主要成分为Na2B4O7,含少量硫酸铁杂质)制备硼(B)单质的部分流程如图所示:已知:BCl3在常温下是一种气体;MgO、B的熔点均高于2000℃。(1)“结晶分离”过程包含蒸发浓缩、和过滤。(2)硼砂粉末中加入NaOH溶液时发生反应的化学方程式为。(3)H3BO3在400℃条件下转变为B2O3的反应属于基本反应类型中的。(4)要获得高纯度的硼单质,选择途径(选填“Ⅰ”或“Ⅱ”)更合理。【解答】解:(1)“结晶分离”过程包含蒸发浓缩、降温结晶和过滤。(2)硼砂粉末中加入NaOH溶液时,氢氧化钠和硫酸铁反应生成氢氧化铁沉淀和硫酸钠,反应的化学方程式为Fe2(SO4)3+6NaOH═2Fe(OH)3↓+3Na2SO4。(3)H3BO3在400°C条件下转变为B2O3和水,由一种物质生成两种物质,属于分解反应。(4)已知:BCl3在常温下是一种气体;MgO、B的熔点均高于2000°C,所以要获得高纯度的硼单质,选择途径Ⅱ更合理。(2023•东莞市校级二模)二硫化钼(MoS2)被誉为“固体润滑剂之王”。利用低品质的辉钼矿(含MoS2、SiO2以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如图所示。(1)操作①的名称是。在实验室该操作需用玻璃棒,其作用是。(2)“氧化焙烧”的温度为500~600℃,主要将MoS2转化为MoO3,同时生成有刺激性气味的气体,反应的化学方程式为。(3)在“氨浸”前,将物质粉碎的目的是;理论上,最终得到的高纯MoS2的质量(选填“>”“=”或“<”)最初的矿石中MoS2质量。(4)操作⑤需要在氩气(Ar)环境中进行,其作用是。【解答】解:(1)过滤可以将不溶性固体从溶液中分离出来,所以操作①的名称是过滤;在实验室该操作需用玻璃棒,其作用是引流。(2)二硫化钼在500﹣550℃时,和氧气反应生成三氧化钼和二氧化硫,化学方程式为:2MoS2+7O2500℃−550℃¯2MoO3+4SO2(2)在“氨浸”前,将物质粉碎的目的是增大反应物的接触面积,加快反应速率,以及在提纯的过程中,会造成钼元素的损耗,所以最终得到的高纯MoS2的质量<最初的矿石中MoS2质量;(3)氢气具有可燃性,和氧气混合加热时易发生爆炸,所以操作⑤过程中,需要Ar的原因是:防止氢气和氧气的混合气,加热时发生爆炸。1、分离和提纯常用的方法(1)物理方法:过滤、吸附、结晶、蒸发和蒸馏等。(2)化学方法:①沉淀法:将混合物中某种成分与某一试剂反应生成沉淀而分离出来;②化气法:将混合物中某种成分与某一试剂反应生成气体而分离出来;③转化法:将杂质用化学试剂转化为待提纯物;2、分离与提纯三不原则(1)不增(不增加新杂质)(2)不减(不减少主要成分)(3)易分离(反应后物质的状态不同,易分离(2023•金寨县模拟)氯化钙常用作干燥剂、路面集尘剂、消雾剂、织物防火剂、食品防腐剂及用于制造钙盐。工业上生产氯化钙的主要工艺流程如图:(1)氯化钙中氯元素的化合价是。(2)为加快“反应器”中的反应速率,可采取的方法是(写出1种即可)。(3)“反应器”中发生的反应属于基本反应类型中的。(4)“酸浸槽”中发生反应的化学方程式为。(5)“脱色池”中利用了活性炭的性。【解答】解:(1)单质中元素化合价为0,化合物中各元素正负化合价代数和为0。氯化钙中钙元素为+2价,所以氯元素化合价x为(+2)+2x=0,x=﹣1;(2)将反应物研磨增加反应面积,搅拌使反应物充分接触可以加快反应速度。所以可以将生石灰研碎或进行搅拌可加快“反应器”中的反应速率;(3)“反应器”中发生的反应是氧化钙和水反应生成氢氧化钙,是多变一的反应,是化合反应;(4)“酸浸槽”中反应器中生成的氢氧化钙和盐酸反应生成氯化钙和水,化学方程式为2HCl+Ca(OH)2=CaCl2+2H2O。(5)活性炭疏松多孔有吸附性,可以吸附色素和异味,根据“脱色池”可知,利用了活性炭的吸附性,吸附带有颜色的物质。(2023•重庆模拟)医学上的“钡餐”是指药用硫酸钡用于消化道的检查,实验室可用如图的方法制取硫酸钡。(已知BaCO3化学性质与CaCO3相似)(1)操作X的名称是。(2)从BaCO3制Ba(OH)2溶液的过程中发生了两个化学反应,任意写其中的一个为,在图中的三个反应中,没有涉及的基本反应类型为反应。(3)固体Y中残留少量可溶物质,向固体Y中加适量水带出可溶物质进入洗涤液,为了证明已洗涤干净,可向最后一次洗涤得到的洗涤液中加入(填序号)进检验,简述判断的标准为。A.澄清石灰水B.碳酸钠溶液C.氯化镁溶液【解答】解:(1)操作X的名称是过滤。故答案为:过滤。(2)从BaCO3制Ba(OH)2溶液的过程中发生了两个化学反应,即高温条件下碳酸钡分解生成氧化钡和二氧化碳,氧化钡和水反应生成氢氧化钡,反应的化学方程式是BaCO3高温¯BaO+CO2↑、BaO+H2O=Ba(OH)2故答案为:BaCO3高温¯BaO+CO2↑或BaO+H2O=Ba(OH)2(3)固体Y中残留少量可溶物质(氢氧化钠),向固体Y中加适量水带出可溶物质进入洗涤液,为了证明已洗涤干净,可向最后一次洗涤得到的洗涤液中加入氯化镁溶液进检验,判断的标准为如果不产生沉淀,说明洗涤干净。故答案为:C;如果不产生沉淀,说明洗涤干净。(2023•硚口区模拟)新型发光陶瓷是将高科技蓄光材料融入传统陶瓷釉料中,经高温烧制而成。它吸蓄光能后,可在水、阴暗环境中自行发光,以下是其部分生产流程。分析流程,回答问题:(1)练泥机将水和坯料充分调和,其作用相当于实验操作中的。(2)施釉机先将蓄光釉料印刷在坯体上,再涂抹一层透明釉料的作用是。(3)生产蓄光材料需要在稀有气体环境中进行,利用稀有气体的性质是。(4)若坯料中铁粉未被除去,则烧制的陶瓷会出现黑点,其原因是(用化学方程式解释)。【解答】解:(1)水和坯料充分调和,相当于搅拌的过程;故答案为:搅拌。(2)透明釉料覆盖自蓄光釉料外部,可以有效隔绝蓄光釉料接触外界,起到很好的保护作用;故答案为:保护内部蓄光釉料。(3)稀有气体化学性质不活泼,可以有效保护釉料不被氧化;故答案为:化学性质不活泼。(4)铁和氧气在点燃条件下反应生成四氧化三铁,化学方程式为:3Fe+2O2点燃¯Fe3O4;故答案为:3Fe+2O2点燃¯Fe3O(2023•安徽模拟)高锰酸钾在生产、生活中有广泛的应用,工业上以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如图所示。【资料】相关物质的溶解度(20℃)如表:物质K2CO3KMnO4溶解度1116.34(1)过滤操作要使用玻璃棒,其作用是。(2)操作1的具体实验步骤为:加热浓缩、、过滤、洗涤、干燥,得到高锰酸钾晶体。干燥时温度不宜过高的原因是(用化学方程式表示)。(3)从经济角度考虑,操作流程中可循环利用的物质是。【解答】解:(1)过滤操作中玻璃棒的作用是引流,防止液体溅出;(2)20℃时,高锰酸钾的溶解度较小,碳酸钾的溶解度较大,所以操作1的具体实验步骤为:加热浓缩、降温结晶、过滤、洗涤、干燥,得到高锰酸钾晶体;干燥时温度不宜过高,是因为高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,该反应化学方程式:2KMnO4△¯K2MnO4+MnO2+O2(3)由流程图可知,二氧化锰参与反应,反应后又生成二氧化锰,因此操作流程中可循环利用的物质是二氧化锰。故答案为:(1)引流;(2)降温结晶;2KMnO4△¯K2MnO4+MnO2+O2(3)二氧化锰。(2023•瑶海区校级模拟)空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。如图是以空气和其他必要的原料合成氮肥(NH4NO3)的工业流程(流程中涉及物质均已列出)。请按要求回答下列问题:(1)步骤①中发生的是(选填“物理”或“化学”)变化,利用各组分的不同进行分离。(2)写出步骤③中发生反应的符号表达式,催化剂在反应前后,本身的质量和不变;氧气具有助燃性,写出铁丝在氧气中燃烧的文字表达式点燃(3)上述化学反应中属于化合反应的有个。【解答】解:(1)工业分离液态空气,没有生成新物质,发生的是物理变化,利用各组分的沸点不同进行分离;(2)步骤③中氨气和氧气生成一氧化氮和水,符号表达式为:NH3+O2→加热催化剂NO+H2O,因为铂是催化剂,所以在反应前后的质量和化学性质不变,铁在氧气中点燃生成四氧化三铁,文字表达式为:铁+氧气(3)步骤①属于物理变化,步骤②氢气和氮气生成氨气,④一氧化氮和水和氧气生成硝酸,⑤硝酸和氨气生成硝酸铵,符合多变一的特点,属于化合反应。故答案为:(1)物理;沸点;(2)NH3+O2→加热催化剂NO+H2O;化学性质;铁+氧气(3)3。(2023•雁塔区校级二模)水是一种宝贵的自然资源,自来水厂的净水流程如图:(1)自来水厂常用氯气杀菌消毒,在此过程中发生了反应Cl2+H2O═HCl+HClO,HClO中氯元素的化合价为。(2)自来水净化过程中,加“絮凝剂”的主要作用是。日常生活中,常采用的方法降低水的硬度。(3)下列实验能证明水是由氢元素和氧元素组成的是(填字母序号)。A.氢气在氧气中燃烧B.水的蒸发C.水的电解D.水的净化(4)下列做法会造成水污染的是(填字母序号)。A.生活污水处理后再排放B.合理使用农药和化肥C.任意排放工业污水【解答】解:(1)在HClO中,氢元素化合价为+1价,氧元素化合价为﹣2价,设氯元素化合价为x,化合物中各元素正负化合价的代数和为零;则(+1)+x+(﹣2)=0,x=+1;(2)絮凝剂溶于水可以吸附水中的悬浮杂质而加速其沉降;硬水是含较多可溶性钙、镁矿物质的天然水,可溶性钙、镁化合物在加热的时候能形成沉淀,故生活中常用加热煮沸的方法降低水的硬度;(3)A、氢气在氧气中燃烧生成水,氢气和氧气分别是由氢、氧元素组成的,可以证明水是由氢元素和氧元素组成的,符合题意;B、水的蒸发是一个物理变化,不能证明水是由氢元素和氧元素组成的,不合题意;C、水的电解生成氢气和氧气,氢气和氧气分别是由氢、氧元素组成的,可以证明水是由氢元素和氧元素组成的,符合题意;D、水的净化是一个除杂灭菌的过程,不能证明水是由氢元素和氧元素组成的,不合题意;(4)A、生活污水处理后再排放,利于水资源保护,不符合题意;B、合理使用农药和化肥可以减少对水的污染,利于水资源保护,不符合题意;C、任意排放工业污水会污染水资源,错误,符合题意。故答案为:(1)+1;(2)吸附水中的悬浮物质,使其加速沉降;煮沸;(3)AC;(4)C。(2023•潼南区二模)侯德榜发明的“侯氏制碱法”为纯碱和氮肥工业的发展做出了杰出贡献。该方法的主要过程如图所示(部分物质已略去)。已知:Ⅰ.侯氏制碱法原理为NaCl+H2O+NH3+CO2=NaHCO3↓+NH4Cl。Ⅱ.反应②的化合价未发生变化。Ⅲ.在溶液A中加入NaCl是为了促进固体析出,未发生化学反应。(1)侯氏制碱法制的“碱”属于(填“酸”“碱”或“盐”)。(2)步骤①②③所涉及的操作方法包括过滤的是(填序号)。(3)该流程中可循环使用的物质是NaCl和(填化学式,下同),溶液C中溶质有NaCl、NaHCO3和。(4)步骤②的化学方程式为。【解答】解:(1)酸是指在水溶液中解离出的阳离子全部是氢离子的化合物,碱是指在水溶液中解离出的阴离子全部是氢氧根离子的化合物,盐是指一类金属离子或铵根离子与酸根离子结合的化合物。侯氏制碱法的“碱”是碳酸钠,由钠离子和碳酸根离子构成,属于盐;(2)过滤是分离难溶物质或固体与液体的操作,步骤①分离碳酸氢钠固体和溶液A,属于过滤;步骤②是加热碳酸氢钠使其分解,不属于过滤,步骤③是分离氯化铵固体和溶液C,属于过滤;①③;(3)该流程中可循环使用的物质是NaCl和步骤②中生成的气体为CO2;氨气、二氧化碳、氯化钠和水共同作用生成碳酸氢钠和氯化铵,步骤①的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;溶液A中溶质有NaHCO3、NH4Cl、NaCl,在溶液A中加入NaCl是为了促进固体析出,未发生化学反应,则溶液C中溶质有NaCl、NaHCO3和NH4C1;(4)步骤②是NaHCO3受热分解生成碳酸钠、水和二氧化碳,其化学方程式为2NaHCO3△¯Na2CO3+H2O+CO2(2023•青秀区校级一模)锰是冶炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有少量FeCO3、NiCO3等杂质)为原料生产金属锰的工艺流程如图,请回答以下问题:(1)步骤Ⅰ中,将碳酸锰矿研磨成粉末的主要目的是,其中碳酸锰与硫酸反应的化学方程式为。(2)步骤Ⅱ中,加入二氧化锰发生以下反应:MnO2+2FeSO4+2H2SO4=MnSO4+2H2O+Fe2(SO4)3,已知滤液1中的主要溶质为MnSO4,同时还含有少量NiSO4,则步骤Ⅱ中加入氨气和水的主要目的是。(3)步骤Ⅲ中,所得滤液2中含有的溶质为MnSO4、(NH4)2SO4,则滤渣2中主要成分为。(填化学式)(4)步骤Ⅳ中,电解后的废液中还含有Mn2+,常用石灰乳进行一级沉降得到沉淀Mn(OH)2和氨气,过滤后,再向滤液中加入Na2S进行二级沉降得到沉淀MnS。沉降过程的产物中,可循环利用于上述流程。【解答】解:(1)由于反应物之间接触越充分,反应也就越快,转化率越高,所以步骤I中,将碳酸锰矿研磨成粉末的主要目的是加快反应速率,提高转化率。碳酸锰与硫酸反应生成硫酸锰、二氧化碳和水,对应的化学方程式为MnCO3+H2SO4═MnSO4+H2O+CO2↑。(2)已知滤液1中的主要溶质为MnSO4,同时还含有少量NiSO4,则步骤II中加入氨水的主要目的是除去硫酸铁。(3)步骤III中,所得滤液2中含有的溶质为MnSO4、(NH4)2SO4,相比镍元素和硫元素没有了,所以滤渣2中主要成分为NiS。(4)步骤Ⅱ中加入氨气和水除杂,步骤IV中,电解后的滤液中还含有Mn2+,常用石灰乳进行一级沉降得到沉淀Mn(OH)2和氨气,沉降过程的产物中,氨气可循环利用于上述流程。(2023•灌云县校级模拟)含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途,以含锌废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO4•7H2O)的流程如图:(1)粉碎的目的是。(2)物质X是,滤渣中含有的金属单质有,除铜时发生的反应属于(填基本反应类型)。(3)流程中获得七水硫酸锌前省略的操作是蒸发浓缩、冷却结晶、、洗涤和低温烘干。(4)某温度下,Fe(OH)3分解得到一种铁、氧比为21:8的氧化物,该氧化物的化学式为。(5)除铁过程中,温度、pH对除铁效果的影响如图所示。由图可知,除铁时温度应控制在℃为宜,pH应控制在为宜。【解答】解:(1)将废渣粉碎能增大接触面积,促进反应的进行;(2)氧化铜和硫酸反应生化池
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 金融办业务培训课件内容
- 校园食品安全教育培训课件
- 金盾保安安全培训课件
- 金牌主持人培训课件
- 金沙湾安全员培训课件
- 最大公因式高等代数
- 金川模式培训安全感想课件
- 校园消防安全教学课件
- 金字塔原理培训课件
- 护理面试试讲中的护理法律法规知识
- 河南洛阳炼化宏达实业有限责任公司招聘笔试题库2026
- 仓库租赁合同协议书
- 企业背景调查报告模板
- 《炎症性肠病》课件
- 2023年兴业银行贵阳分行招聘人员笔试上岸历年典型考题与考点剖析附带答案详解
- DZ∕T 0214-2020 矿产地质勘查规范 铜、铅、锌、银、镍、钼(正式版)
- 加油站百日攻坚行动实施方案
- 马工程版《中国经济史》各章思考题答题要点及详解
- 运输合同纠纷答辩状
- 1、汽车配线、电子连接器及保护装置
- 小学五年级那一刻我长大了600字

评论
0/150
提交评论